题目内容
6.下列反应属于吸热反应的是( )| A. | 稀硫酸与氢氧化钾溶液反应 | B. | 食物腐败 | ||
| C. | 锌与稀硫酸的反应 | D. | 氢氧化钡晶体与氯化铵晶体反应 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:A.稀硫酸与氢氧化钾溶液反应属于酸碱中和反应是放热反应,故A错误;
B.食物腐败是发生了氧化还原反应,属于放热反应,故B错误;
C.锌与稀硫酸的反应是活泼金属与酸的反应,属于放热反应,故C错误;
D.氢氧化钡晶体与氯化铵晶体反应是吸热反应,故D正确.
故选D.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
相关题目
17.n mol H2与n mol D2气体不同之处是( )
| A. | 物质的量 | B. | 原子数 | C. | 质量 | D. | 体积(相同状况) |
14.己知下列反应的能量变化示意图如下,下列有关说法正确的是( )
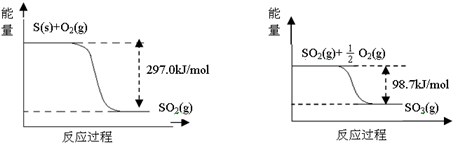

| A. | 1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ | |
| B. | 在相同条件下,SO3(g)比SO2(g)稳定 | |
| C. | 1molSO2(g)和$\frac{1}{2}$molO2(g)生成1molSO3(g)放出98.7kJ的热量 | |
| D. | 由图得S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-198.3kJ/mol |
1.决定金属性强弱的是( )
| A. | 金属原子最外层电子的个数 | |
| B. | 1 mol金属与酸反应放出氢气的多少 | |
| C. | 1 mol金属失去电子的多少 | |
| D. | 金属原子失去电子的难易程度 |
11.下列物质在生活中应用时,起氧化作用的是( )
| A. | 氢氟酸在玻璃器皿上刻蚀标记 | B. | 液氨用作制冷剂 | ||
| C. | 铁粉作食品袋内的脱氧剂 | D. | 漂粉精作消毒剂 |
18.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 2.6g26Al3+中所含的电子数约为6.02×1023 | |
| D. | 26Al3+和26Mg2+的质子数、中子数和电子数均不相同 |
15.下列微粒半径的比值大于1的是( )
| A. | Li+/H- | B. | Cl-/Cl | C. | Na+/F- | D. | Na+/K+ |
16.下列4个图象中,能正确反应变化关系的是( )
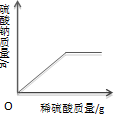 | 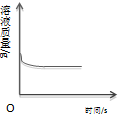 |  | 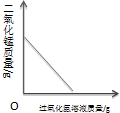 |
| A.向一定质量的氢氧化钠溶液中加入稀硫酸至过量 | B.向一定质量的稀硫酸中加入锌片 | C.加热一定质量的高锰酸钾固体 | D.向一定质量的二氧化锰中加入过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |