题目内容
12.A、B、C、D、E、F分别代表原子序数依次增大的短周期元素.A和D属同族元素;B和F位于第 VIIA族;A和B可形成化合物AB4;C基态原子的s轨道和p轨道的电子总数相等;E的一种单质在空气中能够自燃.请回答下列问题:
(1)D基态原子的电子排布式是1s22s22p63s23p2.
(2)利用价层电子对互斥理论判断EF3的立体构型是三角锥形.
(3)A所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3(填化学式);B和F的氢化物中沸点较高的是HF(填化学式);C、D、F的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2(填化学式).
(4)CuSO4溶液能用作E4中毒的解毒剂,反应可生成E的最高价含氧酸和铜,该反应的化学方程式是P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4.
分析 X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素;Z和U位于第ⅦA族,则Z为F元素,U为Cl;Q基态原子的s轨道和P轨道的电子总数相等,原子序数大于F,核外电子排布为1s22s22p63s2,故Q为Mg;X和Z可形成化合物XZ4,X元素表现+4价,原子序数小于F元素,故X为C元素;X和R属同族元素,则R为Si;T的一种单质在空气中能够自燃,原子序数介于Si与Cl之间,故T为P元素,据此解答.
解答 解:X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素;Z和U位于第ⅦA族,则Z为F元素,U为Cl;Q基态原子的s轨道和P轨道的电子总数相等,原子序数大于F,核外电子排布为1s22s22p63s2,故Q为Mg;X和Z可形成化合物XZ4,X元素表现+4价,原子序数小于F元素,故X为C元素;X和R属同族元素,则R为Si;T的一种单质在空气中能够自燃,原子序数介于Si与Cl之间,故T为P元素.
(1)R为Si元素,基态原子的电子排布式是1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)化合物TU3为PCl3,分子中P原子价层电子对数为3+$\frac{5-1×3}{2}$=4,有1对孤电子对,其立体构型是三角锥形,
故答案为:三角锥形;
(3)X为碳元素,处于第二周期,所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;
Z和U的氢化物分别为HF、HCl,HF分子之间存在氢键,HCl分子之间为范德华力,氢键比范德华力更强,故HF的沸点高于HCl;
Si属于原子晶体,Mg属于金属晶体,氯气属于分子晶体,则熔点由高到低的排列顺序是Si>Mg>Cl2;
故答案为:HNO3;HF;Si>Mg>Cl2;
(4)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜,该反应的化学方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案为:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4.
点评 本题是对物质结构的考查,涉及核外电子排布、分子构型、氢键、元素周期律等,推断元素是解题关键,侧重对基础知识的巩固.

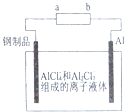 已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )
已知:银锌电池放电时总反应为Zn+Ag2O+H2O═Zn(OH)2+2Ag,用银锌电池作电源,在非水体系中完成钢制品上镀铝的原理如图所示,下列说法正确的是( )| A. | a电极的电极反应式为Ag2O+H2O+2e-=2Ag+2OH- | |
| B. | 银锌电池的电解质溶液可用稀硫酸 | |
| C. | 银锌电池放电时,负极附近溶液的pH增大 | |
| D. | Al电极上发生的电极反应式为Al+7AlCl4--3e-=4Al2Cl4- |
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
(2)表中氧化性最强的单质的化学式为F2;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(4)写出由⑤形成的单质Ne(填化学式符号);
(5)表中能形成两性氢氧化物的元素是Al(填元素符号).
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:c(HCO3-)+c (CO32-)=c(Na+) | |
| C. | 常温下,稀释0.1 mol/L的氨水,水的电离程度减小 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
| A. | HCHO和CH3COOH | B. | HCOOCH3和CH3COOH | ||
| C. | HCOOH和CH3COOH | D. | CH3CH2OH和CH3OCH3 |
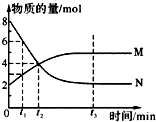 在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2M?N | B. | t2时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的2倍 |
| A. | KCl | B. | HF | C. | NaOH | D. | CaCl2 |
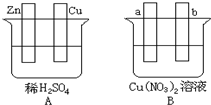 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空: ; ②Cl2
; ②Cl2 ;③CO2
;③CO2 .
.