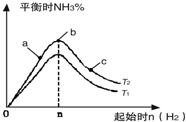
题目内容
11.下列关于Fe(OH)3胶体的说法正确的是( )| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
分析 A、胶体不带电;
B、胶体和溶液的本质区别是分散质粒子直径大小;
C、根据氢氧化铁胶体的制备方法来分析;
D、丁达尔效应是胶体所特有的性质.
解答 解:A、胶体不带电,带电的是胶粒,故A错误;
B、胶体和溶液的本质区别是分散质粒子直径大小,即胶体的胶粒直径介于1-100nm之间,而溶液的分散质粒子小于1nm,故B错误;
C、讲饱和的氯化铁溶液滴入沸水中,继续煮沸,至溶液呈红褐色即停止加热,即可得氢氧化铁胶体,故C正确;
D、丁达尔效应是胶体所特有的性质,溶液没有,即硫酸铜溶液无丁达尔效应,故D错误.
故选C.
点评 本题借助氢氧化铁胶体,考查了氢氧化铁胶体的制备和胶体的性质,难度不大,注意基础的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.对于常温下的下列溶液,说法正确的是( )
| A. | 常温下,向含有AgCl固体的饱和溶液,加少量水稀释,c(Ag+)和Ksp(AgCl)均保持不变 | |
| B. | pH=5的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 将水加热煮沸,能促进水的电离,Kw增大,pH增大,溶液呈碱性 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
19.铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如图:
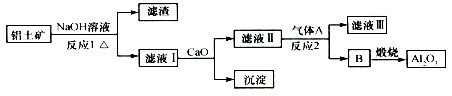
下列说法正确的是( )

下列说法正确的是( )
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
6.下列反应中,最终能生成+3价铁的化合物的是( )
①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
20.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
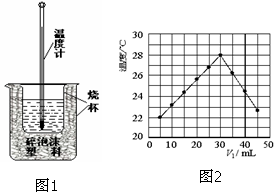 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: