题目内容
14.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | pH=4的醋酸中:c(H+)=4.0mol/L | |
| B. | pH=12的烧碱溶液中:c(OH-)=1.0×10-2mol/L | |
| C. | 饱和食盐水中:c(H+)=c(OH-) | |
| D. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) |
分析 A.醋酸为弱酸,pH=-lg[c(H+)];
B.pH=12的烧碱溶液,c(H+)=1.0×10-12mol/L;
C.饱和食盐水为中性;
D.饱和小苏打溶液中,碳酸氢根离子水解.
解答 解:A.醋酸为弱酸,则pH=4的醋酸中:c(H+)=1.0×10-4mol/L,醋酸浓度大于氢离子浓度,故A错误;
B.pH=12的烧碱溶液,c(H+)=1.0×10-12mol/L,100℃时Kw=1.0×10-12,则c(OH-)=1.0mol/L,故B错误;
C.饱和食盐水为中性,则c(H+)=c(OH-),故C正确;
D.饱和小苏打溶液中,碳酸氢根离子水解,则c(Na+)>c(HCO3-),故D错误;
故选C.
点评 本题考查离子浓度的比较,为高频考点,把握盐类水解、pH的计算及溶液酸碱性判断等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 苯 | B. | 乙烯 | C. | 甲烷 | D. | 聚乙烯 |
| A. | 1mol/L | B. | 2mol/L | C. | 4mol/L | D. | 8mol/L |
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
| A. | 氯化铵 | B. | 硫酸 | C. | 氦气 | D. | 三氧化硫 |
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO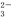 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
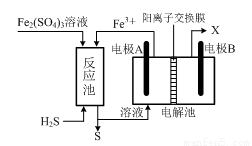
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
 ;
;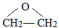 ;
;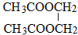 ;
; A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.