题目内容
18. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是S2->O2->Na+ (填具体离子符号);由A、B、C三种元素按4:2:3组成的化合物所含的化学键类型属于离子键、共价键.
(2)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)A、C两元素的单质与熔融K2CO3,组成的燃料电池,其负极反应式为H2+CO32--2e-=CO2↑+H2O,用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时,NaCl溶液的PH=13 (假设电解过程中溶液的体积不变).
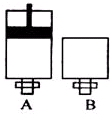
(4)可逆反应2EC2(气)+C2(气)?2EC3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A、B 中分别充入1molC2和2molEC2,使V(A)=V(B),在相同温度下反应,则:①达平衡所需时间:t(A)<t(B)(填>、<、二,或:无法确定,下同).平衡时 EC2的转化率:a(A )>a(B ).
(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有cd(填“序号”).
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和C可形成两种常见的液态化合物,则A为H元素、C为O元素,二者形成的液态化合物为H2O、H2O2,A和D最外层电子数相同,二者同主族,结合原子序数可知,D为Na;B、C和E在周期表中相邻,且C、E同主族,B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,可推知B为N元素、C为O元素、E为S元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和C可形成两种常见的液态化合物,则A为H元素、C为O元素,二者形成的液态化合物为H2O、H2O2,A和D最外层电子数相同,二者同主族,结合原子序数可知,D为Na;B、C和E在周期表中相邻,且C、E同主族,B、C的最外层电子数之和等于D的原子核外电子数,则B、C最外层电子数分别为5、6,可推知B为N元素、C为O元素、E为S元素.
(1)电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径S2->O2->Na+;
由H、N、O三种元素按 4:2:3组成的化合物为NH4NO3,含有离子键、共价键,
故答案为:S2->O2->Na+;离子键、共价键;
(2)H、O、Na组成的化合物为NaOH,废弃的金属易拉罐含有Al,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)氢气、氧气与熔融K2CO3,组成的燃料电池,氢气在负极放电,在熔融碳酸钾条件下生成二氧化碳与水,电解反应式为:H2+CO32--2e-=CO2↑+H2O;
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,氢气的物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,生成的NaOH物质的量=0.05mol×2=0.1mol,故n(OH-)=0.1mol/L,则c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故l溶液的pH=-lg10-13=13,
故答案为:H2+CO32--2e-=CO2↑+H2O;13;
(4)可逆反应2EC2(气)+C2(气)?2EC3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),若在 A、B 中分别充入lmolC2 和2molEC2,使V(A )=V( B ),在相同温度下反应,则:A中压强不变,B中压强减小,故A反应速率更快,达平衡所需时间更短,故t(A)<t(B);A中的压强更高,增大压强平衡向正反应反应移动,平衡时 EC2 的转化率更高,故:a( A )>a( B ),
故答案为:<;>;
(5)a.沸点属于物理性质,不能比较元素的非金属性强弱,故a错误;
b.单质的状态属于物理性质,不能比较元素的非金属性强弱,故b错误;
c.气态氢化物的稳定性,元素的非金属性越强,可以利用氢化物稳定性比较,故c正确;
d.元素的单质与氢气化合的越容易,单质越活泼,元素的非金属性越强,故d正确;
故答案为:cd.
点评 本题比较综合,以元素推断为载体考查结构与位置关系、半径比较、晶体类型与化学键、原电池、化学计算、化学平衡移动、非金属性比较等,推断元素是解题的关键,需要学生对知识全面掌握.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | pH=4的醋酸中:c(H+)=4.0mol/L | |
| B. | pH=12的烧碱溶液中:c(OH-)=1.0×10-2mol/L | |
| C. | 饱和食盐水中:c(H+)=c(OH-) | |
| D. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) |
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T.X.Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为3d84s2.
②元素Q与元素T.Y.Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y.Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
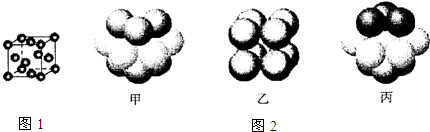
③元素Q形成的单质的晶体结构如图1所示,该晶体形成时的原子堆积方式图2中的是丙 (选填“甲”.“乙”.“丙”).
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Fe3+Br2 | Cl- | |
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯可以燃烧 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯通常易发生取代反应较难发生加成反应 |
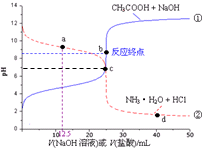
| A. | a点:c(Cl-)>c(NH3•H2O)>c(NH4+) | B. | b点:c(OH-)=c(H+)+c(CH3COOH) | ||
| C. | c点:c(NH4+)=c(CH3COO-) | D. | d点:c(NH4+)>c(Cl-)>c(H+) |
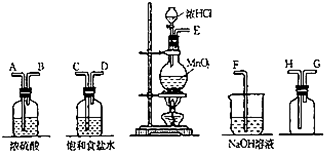 实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: