题目内容
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO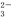 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
练习册系列答案
相关题目
17.下列说法正确的是 ( )
| A. | 工业上冶炼活泼金属的单质都是通过电解法 | |
| B. | 工业上冶炼粗硅是用热还原法 | |
| C. | 消耗等质量的氢气,碱性氢氧电池放电量大于酸性介质的放电量 | |
| D. | 硫酸工业的尾气可以用氨水吸收并制得铵盐 |
14.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=4的醋酸中:c(H+)=4.0mol/L | |
| B. | pH=12的烧碱溶液中:c(OH-)=1.0×10-2mol/L | |
| C. | 饱和食盐水中:c(H+)=c(OH-) | |
| D. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) |
9.已知T.X.Y.Z是中学化学常见的四种元素,其结构或性质信息如表.
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T.X.Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为3d84s2.
②元素Q与元素T.Y.Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y.Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
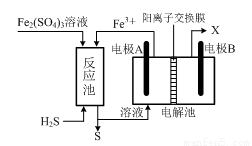
③元素Q形成的单质的晶体结构如图1所示,该晶体形成时的原子堆积方式图2中的是丙 (选填“甲”.“乙”.“丙”).
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T.X.Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为3d84s2.
②元素Q与元素T.Y.Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y.Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③元素Q形成的单质的晶体结构如图1所示,该晶体形成时的原子堆积方式图2中的是丙 (选填“甲”.“乙”.“丙”).

10.下列关于乙烯和苯的叙述中,错误的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯可以燃烧 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯通常易发生取代反应较难发生加成反应 |


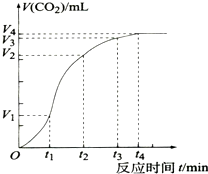 为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:
为了研究CaCO3与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线(图),已知该反应是放热反应,请分析讨论以下问题:
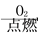 Fe2O3
Fe2O3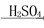 Fe2(SO4)3
Fe2(SO4)3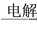 Mg
Mg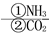 NaHCO3
NaHCO3 Na2CO3
Na2CO3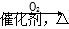 NO
NO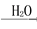 HNO3
HNO3