题目内容
5.有部分化工产品的反应如下(部分反应条件已略去):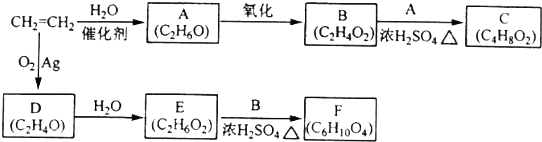
请回答下列问题:
(1)A的工业来源石油裂解;
(2)B和A反应生成C的化学方程式为
 ;
;(3)得到D的反应方程式2 CH2=CH2+O2$→_{△}^{Ag}$2
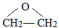 ;
;(4)F的结构简式为
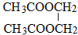 ;
;(5)D的同分异构体的结构简式为CH3CHO.
分析 乙烯与水加成生成A为乙醇,乙醇催化氧化生成B为乙酸,乙酸与乙醇反应生成C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷(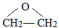 ),D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
),D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(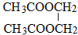 ),据此解答.
),据此解答.
解答 解:乙烯与水加成生成A为乙醇,乙醇催化氧化生成B为乙酸,乙酸与乙醇反应生成C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷(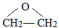 ),D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(
),D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯(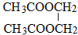 ).
).
(1)工业上通过石油裂解生成乙烯,
故答案为:石油裂解;
(2)B和A反应生成C是乙酸与乙醇反应生成乙酸乙酯,反应方程式为  ,
,
故答案为: ;
;
(3)生成D的反应方程式为:2 CH2=CH2+O2$→_{△}^{Ag}$2 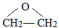 ,
,
故答案为:2 CH2=CH2+O2$→_{△}^{Ag}$2 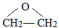 ;
;
(4)由上述分析可知,F为二乙酸乙二酯,结构简式为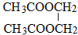 ,
,
故答案为: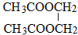 ;
;
(5)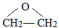 的同分异构体的结构简式为CH3CHO,
的同分异构体的结构简式为CH3CHO,
故答案为:CH3CHO.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质,是对有机化合物知识的综合考查,能较好的考查学生分析思维能力,难度中等,是高考热点题型.

练习册系列答案
相关题目
18.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
13.下列说法正确的是( )
| A. | 重结晶是利用混合物中各组分在某种溶剂中的溶解度不同而使它们相互分离的方法 | |
| B. | 蒸馏时,如果温度计水银球的位置偏高,会导致得到的馏分的沸点偏低 | |
| C. | 在氢氧化镁悬浊液中加入氯化铵溶液,悬浊液溶解证明了氯化铵溶液水解呈酸性 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏低 |
20.下列关于物质的用途或变化的说法正确的是( )
| A. | 耐火陶瓷可以选用熔点很高的 Al2O3等材料制作 | |
| B. | 含量为 99.9999%的高纯硅用于制作光导纤维 | |
| C. | 高炉炼铁可用铝热反应来迚行冶炼 | |
| D. | “雷雨肥田“是因为 N2不O2在放电条件下生成氮的化合物 |
10.正确使用化学用语是学好化学的基础.以下化学用语的使用中不正确的是( )
| A. | 酒精的实验式为:C2H6O | B. | 原子核中有7个中子的碳原子:136C | ||
| C. | 铝离子的电子式:Al3+ | D. | 二氧化硅的结构式O═Si═O |
17.下列说法正确的是 ( )
| A. | 工业上冶炼活泼金属的单质都是通过电解法 | |
| B. | 工业上冶炼粗硅是用热还原法 | |
| C. | 消耗等质量的氢气,碱性氢氧电池放电量大于酸性介质的放电量 | |
| D. | 硫酸工业的尾气可以用氨水吸收并制得铵盐 |
14.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=4的醋酸中:c(H+)=4.0mol/L | |
| B. | pH=12的烧碱溶液中:c(OH-)=1.0×10-2mol/L | |
| C. | 饱和食盐水中:c(H+)=c(OH-) | |
| D. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) |
9.已知T.X.Y.Z是中学化学常见的四种元素,其结构或性质信息如表.
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T.X.Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为3d84s2.
②元素Q与元素T.Y.Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y.Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③元素Q形成的单质的晶体结构如图1所示,该晶体形成时的原子堆积方式图2中的是丙 (选填“甲”.“乙”.“丙”).
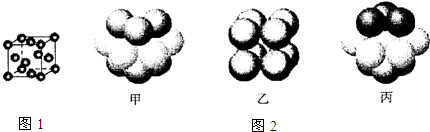
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T.X.Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为3d84s2.
②元素Q与元素T.Y.Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y.Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③元素Q形成的单质的晶体结构如图1所示,该晶体形成时的原子堆积方式图2中的是丙 (选填“甲”.“乙”.“丙”).
