题目内容
14.下列事实与胶体性质无关的是( )| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
分析 A.溶液无丁达尔效应;
B.雾是胶体;
C.明矾水解生成氢氧化铝胶体,胶体颗粒具有吸附性;
D.臭氧、Cl2均可用于水的消毒净化,是由于两者均具有强强氧化性.
解答 解:A.溶液无丁达尔效应,看不到明亮光路,故A正确;
B.雾是胶体,有丁达尔效应,故B正确;
C.明矾水解生成氢氧化铝胶体,胶体颗粒具有吸附性,与胶体有关,故C正确;
D.臭氧、Cl2均可用于水的消毒净化,是由于两者均具有强强氧化性,与胶体性无关,故D错误.
故选D.
点评 本题考查胶体的性质,要求学生熟记教材中提到的胶体的例子,是对基础内容的考查,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
2.为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中.
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
9.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| C. | 0.5mol/L AlCl3溶液中Cl-的数目为1.5NA | |
| D. | 17g氨气中含有的电子数为10NA |
19.下列物质中,所含原子数最多的是( )
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
6.钛(Ti)在生产生活中应用十分广泛,以TiO2制取Ti的主要反应如下:
①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO; ②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti
有关说法错误的是( )
①TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO; ②TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti
有关说法错误的是( )
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
3.“如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动”总结出这条经验规律的科学家是( )
| A. | 门捷列夫 | B. | 盖斯 | C. | 勒夏特列 | D. | 范德华 |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
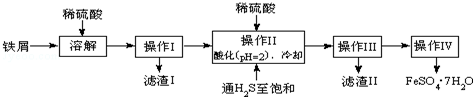
查询资料,得有关物质的数据如下:
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).

查询资料,得有关物质的数据如下:
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)操作Ⅱ中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②防止Fe2+被氧化;③在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O?Fe(OH)2+2H+的平衡常数为:6.1×10-15(保留1位小数).