题目内容
9.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2L CCl4所含的分子数为0.5NA | |
| C. | 0.5mol/L AlCl3溶液中Cl-的数目为1.5NA | |
| D. | 17g氨气中含有的电子数为10NA |
分析 A、求出镁的物质的量,然后根据镁变为镁离子时失去2个电子来分析;
B、标况下四氯化碳为液态;
C、溶液体积不明确;
D、求出氨气的物质的量,然后根据氨气为10电子微粒来分析.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁变为镁离子时失去2个电子,故0.1mol镁失去0.2NA个电子,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、17g氨气的物质的量为1mol,而氨气为10电子微粒,故1mol氨气中含10NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
19.利用如图装置探究铁在海水中的电化学防护,下列说法错误的是( )
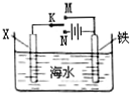

| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
20.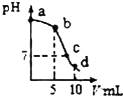 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
17.下列变化不属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
14.下列事实与胶体性质无关的是( )
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
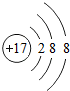
1.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |

 ;
; ;
; 碳和氮的许多化合物在工农业生产和生活中有重要的作用.
碳和氮的许多化合物在工农业生产和生活中有重要的作用.