题目内容
4.下列离子方程式正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+═BaSO4↓ | |
| C. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 硫化钠溶液显碱性:S2-+2H2O?H2S+2OH- |
分析 A.不符合反应客观事实;
B.漏掉镁离子与氢氧根离子的反应;
C.氢氧化钙少量,反应生成碳酸钙和碳酸钠、水;
D.硫离子为多元弱酸根离子,分步水解,以第一步为主.
解答 解:A.氯化铝溶液中加入过量氨水反应生成氢氧化铝沉淀和氯化铵,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.MgSO4溶液中加入Ba(OH)2溶液,离子方程式:Mg2++2OH-+SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故B错误;
C.NaHCO3溶液加入少量Ca(OH)2溶液,离子方程式:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故C正确;
D.硫化钠溶液显碱性,离子方程式:S2-+H2O?HS-+OH-,故D错误;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应应遵循客观事实,遵循原子个数、电荷数守恒规律,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
相关题目
15.某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如表:
(1)制取新制Cu(OH)2悬浊液的离子方程式为Cu2++2OH-═Cu(OH)2↓.
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:
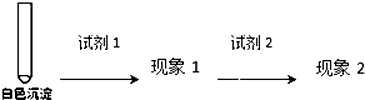
填写如表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:2Cu(OH)2+2Cl-+SO2═2CuCl↓+SO42-+2H2O.
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:

填写如表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
12.某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是均为第ⅤⅡA单质,氧化性均较强.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe3+氧化,离子方程式为2Fe2++Br2=2Fe3++2Br-.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象.
实验3:进行实验以确定可能的原因
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
你认为实验4设计的主要目的是亚铁离子与空气接触会被氧化,加入乙酸乙酯既可作为萃取剂又能起到液封的作用,减少空气对实验的影响.
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe3+的能力逐渐减弱,用原子结构解释原因:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱.
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是均为第ⅤⅡA单质,氧化性均较强.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe3+氧化,离子方程式为2Fe2++Br2=2Fe3++2Br-.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象.
实验3:进行实验以确定可能的原因
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe3+的能力逐渐减弱,用原子结构解释原因:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱.
19.下列离子方程式书写正确的是( )
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
9.对下列物质中锰元素化合价的判断,正确的是( )
| A. | KMnO4中为+3 | B. | MnSO4中为-2 | C. | K2MnO4中为+6 | D. | MnO2中为+2 |
16.检验KCl溶液中是否混有Fe3+时,可选择的试剂是( )
| A. | 硫氰酸钾溶液 | B. | 硝酸 | C. | 盐酸 | D. | 硫酸 |
13.苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面.下列关于苯的叙述不正确的是( )
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
7.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
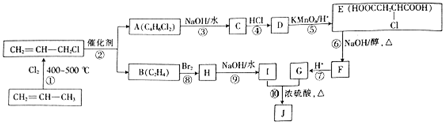
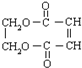 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.