题目内容
17.某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物.(1)为快速得到乙醇气体,可采取的方法是在烧杯中加入热水(对烧杯加热); 若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是c(填写编号);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为试管中出现砖红色沉淀.
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热.为了检验M的组成,进行下列实验.
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是d(填写编号).
a.一定有+3价和+2价铁,一定无0价铁 b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁 d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成.称取a g M样品进行定量测定,实验装置如图1和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧….正确的操作顺序是c(填写编号)
a.①⑤④③②⑥⑦⑧b.①③⑤④②⑦⑥⑧c.①⑤③④②⑥⑦⑧d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中$\frac{x}{y}$=$\frac{2(a-b)}{7b}$.
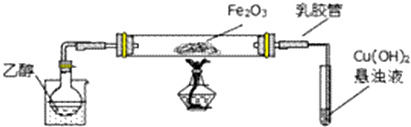
分析 (1)乙醇易挥发,依据图1装置分析可知,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管;
(2)乙醇被催化氧化成乙醛;
(3)乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引;
(4)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
(5)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值.
解答 解:(1)依据图1装置分析可知,乙醇易挥发,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管,
故答案为:在烧杯中加入热水(对烧杯加热);c;
(2)乙醇被催化氧化成乙醛,乙醛与Cu(OH)2悬浊液反应生成Cu2O砖红色沉淀,
故答案为:试管中出现砖红色沉淀;
(3)氧化铁做催化剂参与反应过程,乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引,
故答案为:d;
(4)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c,
故答案为:c;
(5)依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为bg,铁的质量为(a-b)g,依据元素物质的量计算得到比值,n(Fe):n(O)=$\frac{a-b}{56}$:$\frac{b}{16}$=$\frac{2(a-b)}{7b}$,
故答案为:$\frac{2(a-b)}{7b}$.
点评 本题考查了物质性质的实验探究和物质组成的分析判断,题目难度中等,实验操作步骤的设计和完善,实验过程中的反应实质分析判断,现象的理解和应用是解题关键,试题培养了学生的分析、理解能力及化学实验能力.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案| A. | 能自发进行 | B. | 是放热反应 | C. | 不能自发进行 | D. | 处于平衡状态 |
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
| A. | 非金属元素间形成的化学键都是共价键 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的族序数 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 最外层电子数相同的原子属于同一族且化学性质相似 |
| A. | 日常生活中常用无水乙醇做消毒剂 | |
| B. | 乙烯和苯都可以发生加成反应,都可以通过石油分馏得到 | |
| C. | 等物质的量的乙烯和乙醇完全燃烧时消耗氧气的质量相等 | |
| D. | 糖类、油脂、蛋白质都可以水解 |
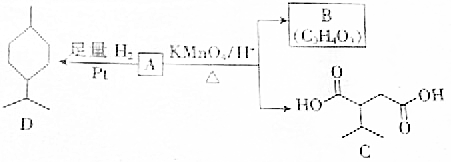
 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.