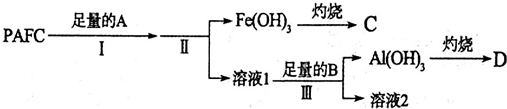
题目内容
12.关于元素在周期表中的位置、原子结构和性质的关系,说法正确的是( )| A. | 非金属元素间形成的化学键都是共价键 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的族序数 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 最外层电子数相同的原子属于同一族且化学性质相似 |
分析 A.铵盐全部由非金属元素组成,为离子化合物;
B.主族元素最高正化合价等于族序数,O、F元素除外;
C.H+、Li+等离子不满足8电子结构;
D.He、Mg最外层电子数都是2,二者不同族,化学性质也不相似.
解答 解:A.因铵盐全部由非金属元素组成,为离子化合物,则全部由非金属元素形成的化合物不一定是共价化合物,故A错误;
B.O、F元素除外,主族元素最高正化合价等于族序数,第三周期主族元素的最高正化合价等于它所处的族序数,故B正确;
C.H+、Li+等离子不满足8电子结构,故C错误;
D.He、Mg最外层电子数都是2,二者不同族,化学性质也不相似,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,难度不大,注意元素周期表中特殊性元素,理解同主族元素性质的相似性与递变性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.今有一混合物水溶液,只可能含有以下离子中的若干种:Na+、Ba2+、Cl-、CO32-、SO42-,现取200mL 溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推断不正确的是( )
| A. | 溶液中一定存在CO32-、SO42-、Na+ | B. | 溶液中 c (Na+)≥0.6mol•L-1 | ||
| C. | 溶液中一定没有Ba2+,可能存在Cl- | D. | 溶液中n(SO42-)≤0.02 mol |
20.下列说法正确的是( )
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
1.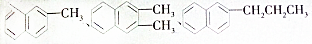 都属于萘(结构简式:
都属于萘(结构简式: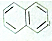 的同系物,则萘和萘的同系物分子组成通式是( )
的同系物,则萘和萘的同系物分子组成通式是( )
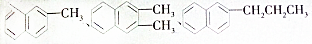 都属于萘(结构简式:
都属于萘(结构简式: 的同系物,则萘和萘的同系物分子组成通式是( )
的同系物,则萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-12(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |