题目内容
 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图(1)该新工艺的优点之一是混合矿料不需要干燥、磨细.烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS2),经过上面设备煅烧后最终化合态的铜生成铜和SO2,在冶炼铜矿过程中存在重要反应:2CuFeS2+O2=Cu2S+2FeS+SO2、2Cu2S+3O2=2Cu2O+2SO2、
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段.第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O2+SiO2=2FeO?SiO2+2SO2,第二阶段是使上一个阶段中没有反应彻底的Cu2S氧化成粗铜,主要化学反应为:②Cu2S+O2=2Cu+SO2,下列关于反应①、②的分析正确的是
A.反应②氧化剂只有O2
B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe2O3、FeO、SiO2等,选用提供的试剂设计实验验证炉渣中含有FeO.提供的试剂:KMnO4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为
考点:铜金属及其重要化合物的主要性质,金属冶炼的一般原理
专题:元素及其化合物
分析:(1)SO2回收利用,防止污染环境,体现绿色化学思想;
(2)开始反应要提供热量,后来不需要了,说明自身是放热反应;
(3)化合态的铜生成铜和SO2,这就要求前两部反应生成的Cu2S和Cu2O反应生成Cu和SO2.
(4)反应②中Cu2S既是氧化剂又是还原剂,反应①、②中都存在O2中的共价键被破坏和SO2 中共价键的形成.(5)FeO+H2SO4=FeSO4+H2O,Fe2+具有还原性,可使酸性KMnO4溶液褪色.
(2)开始反应要提供热量,后来不需要了,说明自身是放热反应;
(3)化合态的铜生成铜和SO2,这就要求前两部反应生成的Cu2S和Cu2O反应生成Cu和SO2.
(4)反应②中Cu2S既是氧化剂又是还原剂,反应①、②中都存在O2中的共价键被破坏和SO2 中共价键的形成.(5)FeO+H2SO4=FeSO4+H2O,Fe2+具有还原性,可使酸性KMnO4溶液褪色.
解答:
解:(1)SO2回收利用,防止污染环境,体现绿色化学思想,故答案为:绿色化学;
(2)开始反应要提供热量,后来不需要了,说明自身是放热反应,故答案为:放热;
(3)化合态的铜生成铜和SO2,这就要求前两部反应生成的Cu2S和Cu2O反应生成Cu和SO2,写出方程式为:2Cu2O+Cu2S=6Cu+SO2↑,故答案为:2Cu2O+Cu2S=6Cu+SO2↑
(4)反应②中Cu2S既是氧化剂又是还原剂,反应①、②中都存在O2中的共价键被破坏和SO2 中共价键的形成,故答案为:BC;
(5)FeO+H2SO4=FeSO4+H2O,Fe2+具有还原性,可使酸性KMnO4溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色.
(2)开始反应要提供热量,后来不需要了,说明自身是放热反应,故答案为:放热;
(3)化合态的铜生成铜和SO2,这就要求前两部反应生成的Cu2S和Cu2O反应生成Cu和SO2,写出方程式为:2Cu2O+Cu2S=6Cu+SO2↑,故答案为:2Cu2O+Cu2S=6Cu+SO2↑
(4)反应②中Cu2S既是氧化剂又是还原剂,反应①、②中都存在O2中的共价键被破坏和SO2 中共价键的形成,故答案为:BC;
(5)FeO+H2SO4=FeSO4+H2O,Fe2+具有还原性,可使酸性KMnO4溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色.
点评:本题考查绿色化学、热效应、书写方程式、物质结构等知识,难度中等.书写方程是难点.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列实验能获得成功的是( )
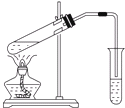

| A、用如图所示装置,只用无水乙酸和乙醇共热就能制取乙酸乙酯 |
| B、将苯逐滴滴入浓溴水中,充分反应后就能制取溴苯 |
| C、将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 |
| D、将苯逐滴滴入酸性高锰酸钾溶液中,溶液最终褪成无色 |
除去NaCl固体中少量泥沙,肯定不会涉及的操作是( )
| A、溶解 | B、蒸馏 | C、搅拌 | D、过滤 |
下列说法正确的是( )
| A、常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B、向NH4HSO4溶液中滴加含等物质的量溶质的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、在0.1mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+c(SO42-) |
| D、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是( )
| A、经常饮用咖啡、碳酸饮料 |
| B、经常饮用钙离子含量高的硬水 |
| C、经常饮用牛奶、豆奶 |
| D、大量补充维生素C |
在乙酸乙酯、乙醇、乙酸水溶液共存的化学平衡体系中加入含18O的水(H218O),经过足够长的时间后,可以发现,除水外体系中含18O的化合物是( )
| A、只有乙醇 |
| B、只有乙酸乙酯、乙醇 |
| C、只有乙酸 |
| D、乙醇、乙酸 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、C2O42- |
| B、0.1mol/LFeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C、0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、水电离出来的c(H+)=1×10-13mol/L的溶液中:Fe2+、Cu2+、SO42-、NO3- |

