题目内容
在乙酸乙酯、乙醇、乙酸水溶液共存的化学平衡体系中加入含18O的水(H218O),经过足够长的时间后,可以发现,除水外体系中含18O的化合物是( )
| A、只有乙醇 |
| B、只有乙酸乙酯、乙醇 |
| C、只有乙酸 |
| D、乙醇、乙酸 |
考点:酯的性质
专题:
分析:乙酸与乙醇的酯化反应为可逆反应,发生酯化反应时乙酸脱-OH,醇脱H,平衡体系中加入H218O,则乙酸中存在18O,以此来解答.
解答:
解:乙酸与乙醇反应,乙酸提供羧基中的-OH,乙醇提供-OH上的H,相互结合生成乙酸乙酯和水,加入H218O后存在平衡CH3CO18OH+CH3CH2OH
H3CCOOCH2CH3+H218O,所以18O出现在H3CCO18OH和H218O,
故选C.
| 浓硫酸 |
| 加热 |
故选C.
点评:本题考查有机物的结构与性质,为高频考点,侧重示踪原子法确定酯化反应反应机理的考查,注意酯化反应的特点及断裂的化学键,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列说法中正确的是( )
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
医院里检测糖尿病的方法病人尿液加入到CuSO4和NaOH的混合液中,加热后产生红色沉淀说明病人的尿液中含有( )
| A、脂肪 | B、乙酸 |
| C、葡萄糖 | D、蛋白质 |
已知在密闭容器中,发生如下可逆反应:2SO2(g)+O2(g)?2SO3(g);△H<0,下列说法不正确的是( )
| A、达平衡时,SO2的消耗速率必定等于O2的生成速率的2倍 |
| B、达平衡时,升高温度,逆反应速率增加,正反应速率减小 |
| C、达平衡后,若保持压强不变,充入少量氖气,则平衡向左移 |
| D、达平衡后,若保持体积不变,充入少量O2气体,则平衡向右移,SO2转化率增大 |
下列叙述或操作正确的是( )
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、硝酸常温下能与铜反应,说明硝酸有强氧化性 |
下列叙述正确的是( )
| A、非金属氧化物一定不是碱性氧化物 |
| B、HCl、H2S、NH3都是电解质 |
| C、漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离 |
| D、Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备 |
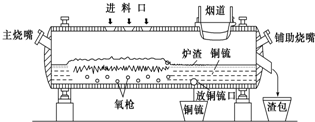 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图 电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答:
电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答: