题目内容
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填1种).
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
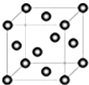
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是 (请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;

(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.
请写出生成此配合离子的离子方程式: .
(1)水分子中氧原子在基态时核外电子排布式为
(2)写出与H2O分子互为等电子体的微粒
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是

(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.
请写出生成此配合离子的离子方程式:
考点:原子核外电子排布,配合物的成键情况,“等电子原理”的应用,晶胞的计算
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)水分子中氧原子的核外电子数为8,根据构造原理写出电子排布式;
(2)根据原子数目和价电子数目来分析等电子体;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此解答;
(4)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(5)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能;
(6)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形.
(2)根据原子数目和价电子数目来分析等电子体;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3,据此解答;
(4)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(5)升华热=范德华力+氢键,利用均摊法计算水分子与氢键的关系,结合升华热、范德华力计算氢键键能;
(6)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形.
解答:
解:(1)水分子中氧原子的核外电子数为8,1s能级上有2个电子,2s能级上有2个电子,2p能级上有4个电子,其电子排布式为1s22s22p4,
故答案为:1s22s22p4;
(2)H2O分子中的原子数为3,价电子数为8,H2S的原子数目为3,价电子数目均为8,则与水互为等电子体,故答案为:H2S;
(3)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A;
(4)冰属于分子晶体,由晶胞图可知,B为二氧化碳的晶胞图,构成微粒为二氧化碳分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,
故答案为:BC;
(5)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,故答案为:20;
(6)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式为:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
故答案为:1s22s22p4;
(2)H2O分子中的原子数为3,价电子数为8,H2S的原子数目为3,价电子数目均为8,则与水互为等电子体,故答案为:H2S;
(3)A.水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.因结构不同,则性质不同,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
故答案为:A;
(4)冰属于分子晶体,由晶胞图可知,B为二氧化碳的晶胞图,构成微粒为二氧化碳分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,
故答案为:BC;
(5)冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),根据图象知,1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol,故答案为:20;
(6)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式为:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
点评:本题考查了电子排布式的书写、等电子体、分子构型、化学键、晶胞的计算等知识点,难点是计算氢键的键能,会运用均摊法计算晶胞是解本题的关键,难度较大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
下列说法中正确的是( )
| A、所有的电子在同一区域里运动 |
| B、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
| C、电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| D、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
以下各微粒中,所有原子或离子不满足最外层都为8电子结构的是( )
| A、Na2O2 |
| B、PCl3 |
| C、CCl4 |
| D、BF3 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
| A、C3H6和C4H6O2 |
| B、C2H4和C2H6O |
| C、C2H2和C6H6 |
| D、CH4O和C3H4O3 |
下列实验能达到相应目的是( )
A、 制备少量的氧气 |
B、 证明氧化性Cl2>Br2>I2 |
C、 将海带灼烧成灰 |
D、 说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
已知在密闭容器中,发生如下可逆反应:2SO2(g)+O2(g)?2SO3(g);△H<0,下列说法不正确的是( )
| A、达平衡时,SO2的消耗速率必定等于O2的生成速率的2倍 |
| B、达平衡时,升高温度,逆反应速率增加,正反应速率减小 |
| C、达平衡后,若保持压强不变,充入少量氖气,则平衡向左移 |
| D、达平衡后,若保持体积不变,充入少量O2气体,则平衡向右移,SO2转化率增大 |
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3辣反应生成CO2. 请回答下列问题: 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图