题目内容
下列说法正确的是( )
| A、常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B、向NH4HSO4溶液中滴加含等物质的量溶质的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、在0.1mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+c(SO42-) |
| D、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.常温下,等物质的量的HCl和CH3COONa混合,二者反应生成等物质的量浓度的CH3COOH和NaCl,醋酸电离导致溶液呈酸性,但电离程度较小;
B.等物质的量的NH4HSO4和NaOH混合,二者反应恰好生成等物质的量浓度的Na2SO4、(NH4)2SO4,铵根离子水解导致溶液呈酸性,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.pH=2的醋酸浓度大于pH=12的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(Na+)、c(CH3COO-)相对大小.
B.等物质的量的NH4HSO4和NaOH混合,二者反应恰好生成等物质的量浓度的Na2SO4、(NH4)2SO4,铵根离子水解导致溶液呈酸性,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.pH=2的醋酸浓度大于pH=12的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(Na+)、c(CH3COO-)相对大小.
解答:
解:A.常温下,等物质的量的HCl和CH3COONa混合,二者反应生成等物质的量浓度的CH3COOH和NaCl,醋酸电离导致溶液呈酸性,但电离程度较小,所以c(CH3COO-)<c(CH3COOH),故A错误;
B.等物质的量的NH4HSO4和NaOH混合,二者反应恰好生成等物质的量浓度的Na2SO4、(NH4)2SO4,铵根离子水解导致溶液呈酸性,根据物料守恒知,其离子浓度大小顺序是c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+2c(SO42-),故C错误;
D.pH=2的醋酸浓度大于pH=12的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故D错误;
故选B.
B.等物质的量的NH4HSO4和NaOH混合,二者反应恰好生成等物质的量浓度的Na2SO4、(NH4)2SO4,铵根离子水解导致溶液呈酸性,根据物料守恒知,其离子浓度大小顺序是c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+2c(SO42-),故C错误;
D.pH=2的醋酸浓度大于pH=12的NaOH,二者等体积混合,醋酸有剩余,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故D错误;
故选B.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,利用守恒思想分析解答,易错选项是B,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
具有下列外围电子排布式的基态原子中,最容易形成离子的是( )
| A、3s23p1 |
| B、2s22p2 |
| C、3s2 |
| D、4s24p3 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
| A、C3H6和C4H6O2 |
| B、C2H4和C2H6O |
| C、C2H2和C6H6 |
| D、CH4O和C3H4O3 |
大量服用阿司匹林会导致( )
| A、便秘 |
| B、食欲不振、缺乏抵抗力 |
| C、腹泻 |
| D、胃溃疡、胃出血 |
关于糖类、油脂、蛋白质的有关说法错误的是( )
| A、糖类是人体获得能量的唯一来源 |
| B、没有蛋白质就没有生命 |
| C、油脂在人体内酶的作用下,可重新合成人体所需的脂肪等物质 |
| D、人体所需的菅养素主要有糖类、油脂、蛋白质、无机盐、维生素和水 |
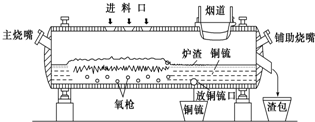 高富氧底吹熔池炼铜新工艺反应炉如图
高富氧底吹熔池炼铜新工艺反应炉如图 电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答:
电解原理在化学工业中有广泛应用.如图中甲、乙为相互串联的两电解池.请回答: