题目内容
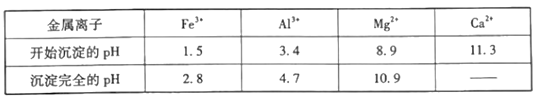
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁样品装入下图的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
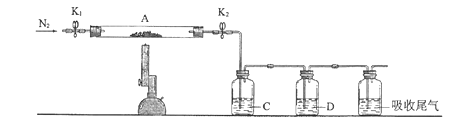
(1)C中的溶液为_______(填标号)。D中观察到的现象为___________。
a .品红 b .NaOH c. BaCl2 d. Ba(NO3)2 e. 浓H2SO4
(2)写出硫酸亚铁高温分解反应的化学方程式_____________。
【答案】c 溶液褪色 2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,根据氧化还原反应的规律,S元素化合价应降低,因此一定生成SO2;FeSO4分解后,铁元素化合价升高1,而S元素化合价降低2,根据化合价升降守恒,化合价降低的S元素只能为总量的一半,因此一定还生成SO3;结合物质的性质分析解答。
(1)实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,根据氧化还原反应的规律,S元素化合价应降低,因此一定生成SO2;FeSO4分解后,铁元素化合价升高1,而S元素化合价降低2,根据化合价升降守恒,化合价降低的S元素只能为总量的一半,因此一定还生成SO3;检验二氧化硫可以选用品红溶液,检验三氧化硫,可以选用氯化钡溶液,因为三氧化硫与水反应生成硫酸,在水中溶解度大于二氧化硫,因此需要首先检验三氧化硫,再检验二氧化硫,因此C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,故答案为:c;溶液褪色;
(2)硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,反应的方程式为2FeSO4 ![]() Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________
【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
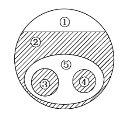
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
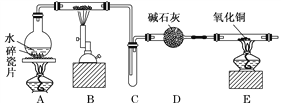
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
【题目】某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图

实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
实验步骤、预期现象和结论(不要求写具体操作过程)____
(4)若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是________