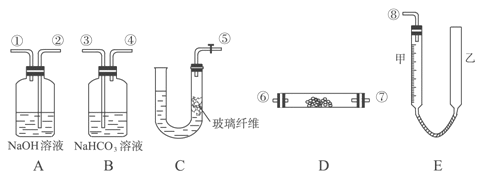
题目内容
【题目】氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为__,钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为___。
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为___。CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是___。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为___。
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________。

(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为___,该晶体的密度为__g·cm-3(阿伏加德罗常数的数值用NA表示)。

【答案】2 4d10 N>O>H>C sp3 CO32-或NO3- 甲基吡咯分子间存在氢键 Mg2Al ![]()
【解析】
(1)Ni是28号元素,原子核外电子排布式为1s22s22p63s23p63d84s2,3d能级有2个未成对电子,基态镍原子的未成对电子数为2;钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,5s上电子数为0,基态钯原子的外围电子排布式为4d10。故答案为:2;4d10;
(2)周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA元素反常,所以C、N和O的第一电离能由大到小的顺序为:N>O>C,又 H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗更多的能量,所以H第一电离能比C的大,故CH3NCO中四种元素的第一电离能由大到小的顺序为N>O>H>C。甲基中C原子VP=BP+LP=4+![]() =4,CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是sp3。故答案为:N>O>H>C;sp3;
=4,CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是sp3。故答案为:N>O>H>C;sp3;
(3)将两个Cl换成O可得与COCl2互为等电子体的一种阴离子为CO32-,再将CO32-中C换成N,又可得到NO3-。故答案为:CO32-或NO3-;
(4)甲基呋哺分子中O上无H,分子间不能形成氢键,甲基吡咯的熔、沸点高于甲基呋喃的原因是甲基吡咯分子间存在氢键。故答案为:甲基吡咯分子间存在氢键;
(5)该晶胞中Al原子个数为2×![]() =1、Mg原子个数=8×
=1、Mg原子个数=8×![]() +2×
+2×![]() =2,所以其化学式为Mg2Al;晶胞体积=(a×10-7 cm)3,该晶体的密度=
=2,所以其化学式为Mg2Al;晶胞体积=(a×10-7 cm)3,该晶体的密度=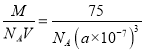 g·cm-3=
g·cm-3=![]() g·cm-3,故答案为:Mg2Al;
g·cm-3,故答案为:Mg2Al;![]() 。
。

 名师伴你成长课时同步学练测系列答案
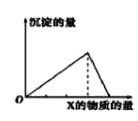
名师伴你成长课时同步学练测系列答案【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
【题目】在汽车上安装高效催化转化器,可发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 甲 | 乙 | |||||||||||
0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | ||
c(NO)(×10-4mol/L) | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
c(CO)(×10-3mol/L) | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 | |
下列说法正确的是:
A.通过甲乙组数据对比可知,催化剂可以让原来不能自发进行的反应体系自发进行
B.根据化学反应原理综合分析可知:反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) 的△H<0
N2(g)+2CO2(g) 的△H<0
C.乙容器中,0~
D.达到平衡后,将容器乙中各物质的浓度均加倍,则体系K值增加,平衡正向移动