题目内容
【题目】以镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]为原料制取六水合氯化镁(MgCl2·6H2O),具体的工艺流程如图:
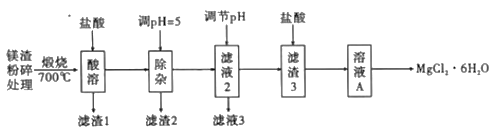
已知:①滤液2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],当x=1,m=0时,碱式氯化镁为Mg(OH)Cl。
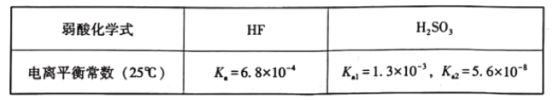
②相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
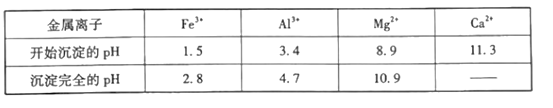
请回答下列问题:
(1)实验室煅烧样品的实验仪器为__。
(2)滤渣2的主要成分是__。
(3)通过调节滤液2的pH来获取Mg(OH)2沉淀,则溶液pH的范围为___。
(4)向溶液A中先加入___(填化学式)酸化,然后___、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O,取少量低温干燥得到的MgCl2·6H2O晶体溶于水后发现溶液呈碱性,则含有的杂质是__从操作上分析引入杂质的原因是__。
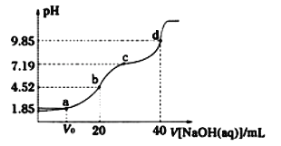
(5)热重分析法是程序控制温度下测最物质的质量与温度关系的一种实验技术。MgCl2·6H2O的热重曲线如图。已知:MgCl2·6H2O在空气中受热脱水时,不产生无水氯化镁。
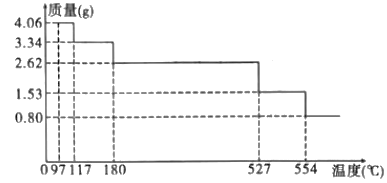
①试确定200℃时固态物质的化学式:___。
②温度升至554℃时分解得到的主要产物为白色固体和一种酸性气体,写出该反应的化学方程式:___。
【答案】坩埚 Fe(OH)3 Al(OH)3 10.9≤pH<11.3 HCl 蒸发浓缩 碱式氯化镁或氢氧化镁 过度蒸发导致氯化镁水解 MgCl2·2H2O Mg(OH)Cl![]() MgO+HCl
MgO+HCl
【解析】
以镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]为原料制取六水合氯化镁(MgCl2·6H2O),由流程可知,镁渣在700℃煅烧,只发生MgCO3和Mg(OH)2的分解反应,然后在固体中加入盐酸,可与MgO、CaCO3、Al2O3、Fe2O3反应生成氯化镁,氯化钙、氯化铁,滤渣1为SiO2,调节pH=5,铁离子和铝离子沉淀完全,滤渣2为Al(OH)3 和Fe(OH)3,溶液中只余下氯化镁和氯化钙,再调节10.9≤pH<11.3,将镁沉淀,最后在滤渣3中加盐酸酸化得溶液A,然后蒸发浓缩、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O。
(1)固体灼烧用坩埚,实验室煅烧样品的实验仪器为坩埚。故答案为:坩埚;
(2)调节pH=5,铁离子和铝离子沉淀完全,滤渣2的主要成分是Fe(OH)3、Al(OH)3。故答案为:Fe(OH)3 、Al(OH)3;
(3)PH大于10.9时Mg(OH)2沉淀完全,常温下,饱和石灰水的pH约为11.3,通过调节滤液2的pH来获取Mg(OH)2沉淀,则溶液pH的范围为10.9≤pH<11.3。故答案为:10.9≤pH<11.3;
(4)为防止引入新的杂质,向溶液A中先加入HCl酸化,然后蒸发浓缩、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O,取少量低温干燥得到的MgCl2·6H2O晶体溶于水后发现溶液呈碱性,则含有的杂质是碱式氯化镁或氢氧化镁,从操作上分析引入杂质的原因是过度蒸发导致氯化镁水解。故答案为:HCl;蒸发浓缩;碱式氯化镁或氢氧化镁;过度蒸发导致氯化镁水解;
(5)①n(MgCl2·6H2O)=![]() =0.02mol,m(MgCl2)=0.02mol×95g·mol-1=1.9g,200℃时,失去部分结晶水,固体中结晶水2.62g-1.9g=0.72g,n(H2O)=
=0.02mol,m(MgCl2)=0.02mol×95g·mol-1=1.9g,200℃时,失去部分结晶水,固体中结晶水2.62g-1.9g=0.72g,n(H2O)=![]() =0.04mol,200℃时固态物质中:n(MgCl2):n(H2O)=0.02:0.04=1:2,200℃时固态物质的化学式:MgCl2·2H2O。故答案为:MgCl2·2H2O;
=0.04mol,200℃时固态物质中:n(MgCl2):n(H2O)=0.02:0.04=1:2,200℃时固态物质的化学式:MgCl2·2H2O。故答案为:MgCl2·2H2O;
②加热到一定的温度,水解程度增大,生成碱式氯化镁和氯化氢,故温度升至554℃时分解得到的主要产物为白色固体和一种酸性气体,该反应的化学方程式:Mg(OH)Cl![]() MgO+HCl。故答案为:Mg(OH)Cl
MgO+HCl。故答案为:Mg(OH)Cl![]() MgO+HCl。
MgO+HCl。