题目内容
19. 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:(1)铜元素在元素周期表中位于第四周期ⅠB族,其原子基态价层电子排布式为3d104s1.
(2)Cu2O的熔点比Cu2S的高,原因为Cu2O与Cu2S相比较,其阳离子相同、阴离子所带的电荷也相同,但由于氧离子的半径小于硫离子的离子半径,Cu2O的晶格能更大(或亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键),所以Cu2O的熔点比Cu2S的高.
(3)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂.
①写出CO的一种常见等电子体分子的结构式N≡N;
两者相比较沸点较高的为CO(填分子式).
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)═Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为金属键.
(4)已知AlCl3•NH3有配位键.在AlCl3•NH3中,提供空轨道的原子是Al;在NH4+中N原子的杂化轨道类型为sp3.
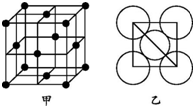
(5)金属铝的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示.则晶体铝中原子的堆积方式为面心立方最密堆积.已知:铝原子半径为d cm,摩尔质量为Mg•mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=$\frac{M}{4\sqrt{2}{N}_{A}{d}^{3}}$g/cm3(表达式).
分析 (1)根据铜在元素周期表中的位置来书写基态原子电子排布式,然后确定原子基态价层电子排布式;
(2)Cu2O和Cu2S同属于离子晶体,离子晶体熔点的高低要通过晶格能的大小来判断;
(3)①由等电子体定义可知CO的一种常见等电子体为氮气,CO为极性分子熔点高;
②断裂配位键后,配体变为CO,中心原子结合成金属晶体;
(4)中心原子提供空轨道,通过计算Al价层电子对数求杂化类型;
(5)根据图乙可推算堆积方式为ABCABC…,可通过求每个晶胞的质量和体积计算密度.
解答 解:(1)铜是29号元素,位于第四周期ⅠB族,外围电子排布要遵循洪特规则特例为3d104s1,
故答案为:第四周期ⅠB族 3d104s1;
(2)Cu2O和Cu2S同属于离子晶体,其阳离子相同、阴离子所带的电荷也相同,由于离子的半径小于硫离子的离子半径,所以Cu2O的晶格能大,熔点高,
故答案为:Cu2O与Cu2S相比较,其阳离子相同、阴离子所带的电荷也相同,但由于氧离子的半径小于硫离子的离子半径,Cu2O的晶格能更大(或亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键),所以Cu2O的熔点比Cu2S的高;
(3)①CO的等电子体为氮气,氮气的结构式为N≡N,对于相对分子质量相等的分子晶体而言,极性分子沸点高,CO为极性分子,氮气为非极性分子,CO的沸点高,
故答案为:N≡N;CO;
②此配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体,
故答案为:金属键;
(4)AlCl3•NH3中Al为中心原子,NH3和Cl-为配体,中心原子提供空轨道,AlCl4-的价层电子对=4+(3+1-4×1)=4,故Al采用sp3杂化,
故答案为:Al;sp3;
(5)结合图乙和晶胞结构可知,金属铝中Al的堆积方式为ABCABCABC…,属于面心立方最密堆积,
铝原子半径为d cm,则晶胞的边长为2$\sqrt{2}$dcm,晶胞的体积V=(2$\sqrt{2}$d cm)3=16$\sqrt{2}$d3cm3,一个晶胞含有Al原子个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,一个晶胞的质量m=$\frac{4}{{N}_{A}}$×Mg,故密度ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{16\sqrt{2}{d}^{3}}$g/cm3=$\frac{M}{4\sqrt{2}{N}_{A}{d}^{3}}$g/cm3,
故答案为:面心立方最密堆积;$\frac{M}{4\sqrt{2}{N}_{A}{d}^{3}}$g/cm3.
点评 本题考查较为综合,涉及晶胞计算、基态电子排布式、晶体熔沸点的比较较等知识,题目难度中等,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析能力及灵活应用能力.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| 结构简式 | 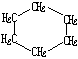 | 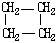 | Br-CH2-CH2-CH(CH3)-CH2-Br |
| 键线式 | 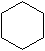 (环己烷) (环己烷) |  (环丁烷) (环丁烷) |  |

回答下列问题:
(1)环烷烃与相同碳原子数的烯烃(或相对分子质量相同的烯烃)是同分异构体.
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是环丙烷(填名称),判断依据为在都使用催化剂的条件下,加成反应的温度最低.
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为
 (不需注明反应条件)
(不需注明反应条件)(4)写出鉴别环丙烷与丙烯的一种方法,试剂酸性高锰酸钾溶液;现象与结论使酸性高锰酸钾溶液退色的是丙烯,另一种是环丙烷(或溴水,使溴水退色的是丙烯).
(5)已知某烯烃在酸性高锰酸钾的作用下只产生一种有机物C3H6O,其产物物质的量是原烯烃的两倍且其氢核磁共振谱图上只有一个峰,则该烯烃的结构简式为C(CH3)2=C(CH3)2,系统名称为2,3-二甲基-2-丁烯.
| A. | C3H8 | B. | C2H6 | C. | C2H4 | D. | C6H6 |
| 选项 | 实验 | 方法或现象 | 结论 |
| A | 检查该装置气密性: | 将注射器针管向右拉动一段距离后松手,能够恢复原位 | 气密性良好 |
| B | 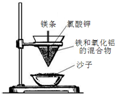 | 点燃镁条后,火花四射,在蒸发皿中产生红热的金属 | 铝热反应: 2Fe+Al2O3$\frac{\underline{\;高温\;}}{\;}$2Al+Fe2O3 |
| C | 将SO2气体通入氢硫酸溶液中 | 有黄色浑浊产生 | 还原性:H2S>SO2 |
| D | 制备CuSO4 | 方法一:用Cu与浓硫酸反应 方法二:用Cu与稀硫酸在不断通入O2的情况下反应 | 方法二更符合绿色化学理念 方法一的原子利用率更高 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,但纤维素与淀粉不是同分异构体 |
| 选项 | 实验操作 | 实验现象 |
| A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
| B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
| C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
| D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
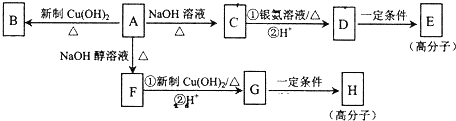
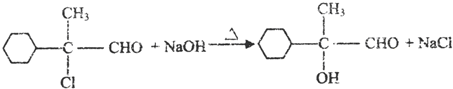 .
.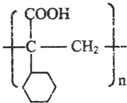 ,E的结构简式是
,E的结构简式是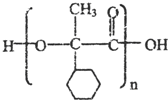 .
.