题目内容
14.下列实验操作或方案正确的是( )
| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
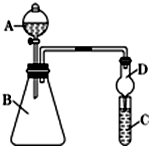
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
分析 A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳不反应,浓硫酸具有吸水性;
B.碘易升华,KI加热不反应,但无法回收碘;
C.亚铁离子不稳定,易被空气氧化生成铁离子;
D.NaOH和氯气、HCl都反应.
解答 解:A.二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳不反应,浓硫酸具有吸水性,所以该实验能得到干燥纯净的二氧化碳,能实现实验目的,故A正确;
B.KI加热不反应,易升华生成碘蒸气,但该装置无法回收碘,故B错误;
C.亚铁离子不稳定,易被空气氧化生成铁离子,且FeSO4•7H2O受热易分解,所以不能直接蒸干FeSO4饱和溶液来制备FeSO4•7H2O,故C错误;
D.NaOH和氯气、HCl都反应,应该用饱和食盐水除去氯气中的HCl,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、物质制备、物质分离和提纯等知识点,明确实验原理、物质性质差异性是解本题关键,注意除杂时要防止引进新的杂质,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.某厂利用一批回收的废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为MgO、Cr2O3、FeO、SiO2,工艺流程为:
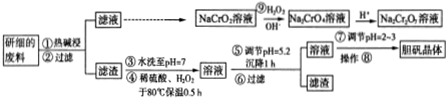
提示:25℃时,部分金属阳离子以氢氧化物形式完全沉淀(离子浓度小于等于10-5mol•L-1)时溶液的pH如下表:
回答下列问题:
(1)25℃时,Ksp[Fe(OH)3]的数值为10-38.3
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为Cr2O3+2OH-=2CrO2-+H20
步骤④中与H2O2反应的物质和离子是Cu、Fe2+
步骤⑤中调节溶液pH时适宜的物质是bc(填序号)
a.NaOH b.CuO c.Cu(OH)2
(3)操作⑧的分离方法是蒸发浓缩、冷却结晶、过滤,这样得到的胆矾晶体中除铜元素外还含有一种金属元素,这种金属元素的氧化物的电子式为 .
.
(4)步骤⑨中氧化剂与还原剂的物质的量之比为3:2;硫酸酸化的Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,该反应可用于检测司机是否酒驾,相应的化学方程式为3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4.

提示:25℃时,部分金属阳离子以氢氧化物形式完全沉淀(离子浓度小于等于10-5mol•L-1)时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
(1)25℃时,Ksp[Fe(OH)3]的数值为10-38.3
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为Cr2O3+2OH-=2CrO2-+H20
步骤④中与H2O2反应的物质和离子是Cu、Fe2+
步骤⑤中调节溶液pH时适宜的物质是bc(填序号)
a.NaOH b.CuO c.Cu(OH)2
(3)操作⑧的分离方法是蒸发浓缩、冷却结晶、过滤,这样得到的胆矾晶体中除铜元素外还含有一种金属元素,这种金属元素的氧化物的电子式为
 .
.(4)步骤⑨中氧化剂与还原剂的物质的量之比为3:2;硫酸酸化的Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,该反应可用于检测司机是否酒驾,相应的化学方程式为3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4.
2.下列叙述正确的是( )
| A. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| B. | 铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 | |
| C. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| D. | 凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
9.25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20.00mL浓度均为0.l000mol/L的二种酸HX、HY(忽略体积变化),实验数据如表,下列判断不正确的是( )
| 数据 编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 由表中数据可估算出HX的电离常数Ka(HX)≈10-5 | |
| B. | 向上述实验③HX反应后的溶液中加入实验①中的HY溶液前后,水的电离程度增大 | |
| C. | 表中x<7,y=7 | |
| D. | 上述向HX中加amLNaOH时,溶液中c(Na+)=c(X-) |
6.钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求.一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3+2Na2NiFeⅡ (CN)6$?_{充电}^{放电}$Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态).下列说法不正确的是( )
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
 小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
小明和同班同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验. 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
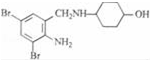 ,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)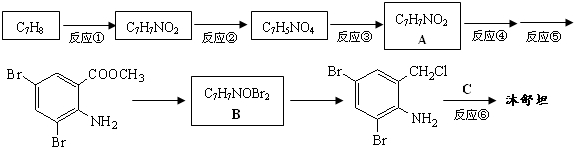
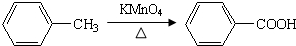 ,完成下列填空:
,完成下列填空: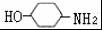 +2
+2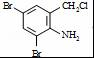 +K2CO3→2
+K2CO3→2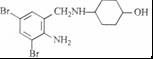 +2KCl+CO2↑+H2O.
+2KCl+CO2↑+H2O.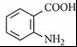 B
B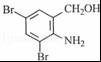 .
.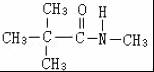 、
、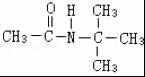 .
.