题目内容
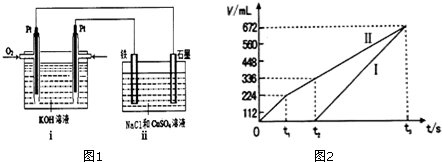
3.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液.下列说法正取的是( )| A. | 负极反应为:O2+2H2O+4e-═4OH- | |
| B. | 负极反应为:2H2+4OH--4e-═4H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
分析 氢氧燃料电池工作时,氢气失电子发生氧化反应;氧气得电子发生还原反应;电解质溶液是KOH溶液(碱性电解质),正极是O2得到电子,正极的电极反应式为:O2+2H2O+4e-═4OH-,负极发生的反应为:2H2+4OH-=4H2O+4e-,根据电极反应判断两极pH的变化.
解答 解:A.电池工作时,负极氢气失电子发生氧化反应,负极发生的反应为:2H2-4e-+4OH-═4H2O,故A错误;
B.电池工作时,负极氢气失电子发生氧化反应,负极发生的反应为:2H2-4e-+4OH-═4H2O,故B正确;
C.电池工作时溶液中的阴离子移向负极,阳离子移向正极,故C错误;
D.正极的电极反应式为:O2+2H2O+4e-═4OH-,负极发生的反应为:2H2+4OH-=4H2O+4e-,由电极反应式可知,电池工作时正极区pH升高,负极区pH下降,故D错误;
故选B.
点评 本题考查原电池知识,题目难度不大,本题注意把握电解反应式的书写为解答该题的关键,注意溶液的酸碱性对电极方程式的影响.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
13.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于64.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min)
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是AD
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
I.已知反应Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于64.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min)
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
14.在容积不变的密闭容器中,一定条件下发生反应:2A?B(g)+2C(g),且达到平衡.当升高温度时气体的密度增大,则下列叙述中正确的是( )
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 若向容器中充入惰性气体,则平衡向右移动 | |
| D. | 物质A一定为非气态,且正反应是吸热反应 |
18.下列说法正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 乙烯和苯都能使溴水褪色,褪色原理相同 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
15.下列各种情况,有机物同分异构体数目最多的是( )
| A. | 甲苯苯环上的一个氢原子被-C3H7的烷基取代 | |
| B. | C5H12被C12取代生成的一氯代物 | |
| C. | 与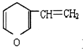 互为同分异构体的芳香族化合物 互为同分异构体的芳香族化合物 | |
| D. | 菲( 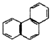 )的一硝基取代物 )的一硝基取代物 |
12.下列正确的是( )
| A. | 碳酸的电离:H2CO3?H++HCO3- | B. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | ||
| C. | Na2CO3溶液中:c(HCO3-)>c(OH-) | D. | NH4Cl溶液中,c(NH4+)>c(Cl-) |
13.下列关于钠的化合物说法正确的是( )
| A. | 碳酸氢钠俗称苏打 | |
| B. | 鉴别Na2CO3和NaHCO3两种无色溶液,可以分别滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | NaHCO3的热稳定性大于Na2CO3 | |
| D. | 向滴有酚酞试剂的水中加入足量的Na2O2粉末并振荡,溶液由无色变红最后又变无色 |