题目内容
9.下列有关用标准浓度的氢氧化钠溶液滴定未知食醋浓度的相关说法不正确的是( )| A. | 实验必需仪器有滴定管、锥形瓶、滴定管夹架台 | |
| B. | 若选择甲基橙作指示剂,则测得食醋中CH3COOH浓度偏高 | |
| C. | 滴定之前的操作是选滴管、检漏、水洗、润洗、装液、调液面、读数 | |
| D. | 开始俯视读数,终点时仰视读数,测得食醋中CH3COOH浓度偏高 |
分析 A.酸碱中和滴定实验中,需要酸、碱滴定管,及固体滴定管的夹架台,待测溶液需要盛放在锥形瓶中;
B.甲基橙的变色范围是3-5,当溶液瞬间变黄色时溶液可能仍显酸性;
C.滴定操作时要准备实验需要的滴定管,并对滴定管进行检漏、水洗、润洗、装液、调整液面及读数等操作;
D.滴定管的0刻度在上方,仰视时液面在刻度线的上方,俯视时液面在刻度线下方.
解答 解:A.酸碱中和滴定实验中,必需仪器有滴定管、滴定管的夹架台及锥形瓶,故A正确;
B.完全中和时生成的CH3COONa溶液显碱性,当溶液瞬间变黄色时溶液可能仍显酸性,此时消耗的标准NaOH溶液偏少,测得醋酸的浓度偏低,故B错误;
C.滴定之前需要进行的操作是选用合适的滴定管,并对滴定管进行检漏、水洗、润洗、装液、调整液面及读数等操作,故C正确;
D.开始俯视读数,终点时仰视读数,则读数比实际消耗的标准液体积偏高,导致测得食醋中CH3COOH浓度偏高,故D正确;
故选B.
点评 本题以酸碱中和滴定为载体,考查实验的基本操作,涉及仪器的选用、误差的分析等,属基础性考查,难度不大,易错点为D,关键是要分清刻度线与液面的关系,及滴定管的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.几乎在每天的电视广告中,都有补钙药物的宣传,对合格补钙药品不正确的认识是( )
| A. | 它有利于儿童牙齿的生长 | |
| B. | 它有利于骨骼的生长和发育 | |
| C. | 它有利于化合物Ca10(PO4)6(OH)2的生成 | |
| D. | 它使儿童更聪明 |
4.下列离子方程式书写正确的是( )
| A. | 等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
14.汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,汽车尾气的治理已经迫在眉睫.
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
该反应的△H<0(填“>”或“<”)若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下达到平衡时,CO的转化率为75%.
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.
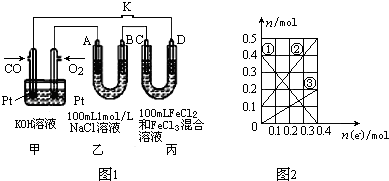
①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.
(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
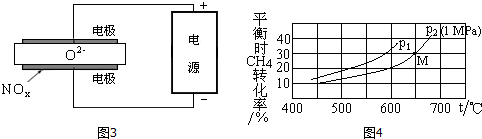
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.

①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.

(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
1.1999年4月,俄、美科学家宣布用86Kr核轰击208Pb靶合成了118号元素的一个同位素${\;}_{118}^{293}$Pb,关于118号元素的下列说法正确的是( )
| A. | 118号元素的相对原子质量为293 | |
| B. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的质量数为293 | |
| C. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的中子数为293 | |
| D. | 118号元素应为周期表中第8周期的元素 |
19.金刚石的熔点低于石墨,原因可能是 ( )
| A. | 石墨中还有范德华力 | |
| B. | 石墨熔化也要破坏共价键,且键长更短 | |
| C. | 石墨热稳定性更好 |