题目内容
7.单质A与水蒸气反应生成B,B溶于盐酸生成C(棕黄色)和D(浅绿色)的混合物,若要除去混合物中的C应加入的试剂是铁粉,离子方程式是2Fe3++Fe=3Fe2+;若要除去混合物中的D应加入的试剂是氯气,离子方程式是2Fe2++Cl2=2Fe3+.若要检验混合物中的C应加入的试剂是KSCN溶液,发生的离子方程式是Fe3++3SCN-=Fe(SCN)3;若要检验混合物中的D加入试剂是高锰酸钾溶液,发生反应的离子方程式是5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.分析 单质A与水蒸气反应生成B,B溶于盐酸生成C(棕黄色)和D(浅绿色)的混合物,即B溶于盐酸后反应后得到含Fe3+和Fe2+的溶液,据此可知A、B、C、D;要除去Fe2+中的Fe3+,应利用发生2Fe3++Fe=3Fe2+来分析;若除去FeCl3中的FeCl2,应加入氯气做氧化剂;Fe3+的检验用KSCN溶液,生成血红色Fe(SCN)3;检验Fe3+中的Fe2+,用KMnO4溶液,在酸性条件下能被Fe2+还原而褪色来检验.
解答 解:单质A与水蒸气反应生成B,B溶于盐酸生成C(棕黄色)和D(浅绿色)的混合物,即B溶于盐酸后反应后得到含Fe3+和Fe2+的溶液,据此可知B为Fe3O4,C为FeCl3,D为FeCl2;要除去Fe2+中的Fe3+,应利用加入铁饭能发生2Fe3++Fe=3Fe2+,既能除去Fe3+还不引入杂质;若除去FeCl3中的FeCl2,应加入氯气做氧化剂,能将Fe2+氧化为Fe3+:2Fe2++Cl2=2Fe3+;Fe3+的检验用KSCN溶液,生成血红色Fe(SCN)3:Fe3++3SCN-=Fe(SCN)3;检验Fe3+中的Fe2+,用KMnO4溶液,在酸性条件下能被Fe2+还原而褪色:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.故答案为:铁粉;2Fe3++Fe=3Fe2+;氯气;2Fe2++Cl2=2Fe3+;KSCN溶液;Fe3++3SCN-=Fe(SCN)3;高锰酸钾溶液;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题考查了铁的氧化物与酸的反应产物的检验和除杂,难度不大,应注意的是铁离子的检验用KSCN溶液.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.化学与生活密切相联,下列应用中利用了物质的氧化性的是( )
| A. | SO2漂白纸浆 | B. | 纯碱清洗油污 | ||
| C. | Na2S除污水中的Cu2+ | D. | 漂白粉漂白织物 |
18.如图是用稀HNO3和Cu制取少量NO并验证氮氧化合物性质的装置.下列说法错误的是( )
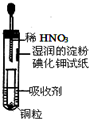

| A. | 吸收剂可以是NaOH溶液 | B. | 试管上部的气体始终为无色 | ||
| C. | 小试管中溶液最终呈蓝色 | D. | 试纸先变红后褪色 |
15.二氧化氯是国际上公认的含氯消毒剂中位移的高效消毒灭菌剂,对一切经水体传播的病原微生物均有很好的杀灭效果,在水处理等方面应用广泛.二氧化氯的部分性质如表.某小组拟用如图A所示装置模拟工业发用潮湿的KCIO3和草酸(H2C2O2)在60℃时反应制取收集液态ClO2
回答下列问题:
(1)仪器A的名称是圆底烧瓶
(2)温度计的作用是测量反应温度,使用电动搅拌泵搅拌反应混合物的目的是增大反应速率
(3)保存液态ClO2的条件是d(填字母)
a.常温、密封、不避光 b.低温、敞口、不避光 c.常温、敞口、避光 d.低温、密封、避光
(4)烧碱溶液的作用是吸收尾气
(5)亚氯酸钠(NaClO2)也可用于二氧化氯的制备
①观察亚氯酸钠的溶解度曲线图B,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是减压蒸发,温度略高于(或大于)38℃
②设计实验方案,验证酸性条件下亚氯酸钠的氧化性强于碘(I2)在淀粉碘化钾溶液中加入少量NaClO2溶液,并加入少量的稀硫酸,溶液变蓝说明亚氯酸钠的氧化性强于碘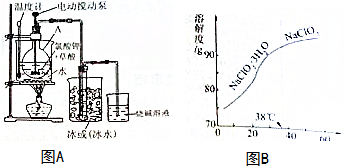
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
(1)仪器A的名称是圆底烧瓶
(2)温度计的作用是测量反应温度,使用电动搅拌泵搅拌反应混合物的目的是增大反应速率
(3)保存液态ClO2的条件是d(填字母)
a.常温、密封、不避光 b.低温、敞口、不避光 c.常温、敞口、避光 d.低温、密封、避光
(4)烧碱溶液的作用是吸收尾气
(5)亚氯酸钠(NaClO2)也可用于二氧化氯的制备
①观察亚氯酸钠的溶解度曲线图B,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是减压蒸发,温度略高于(或大于)38℃
②设计实验方案,验证酸性条件下亚氯酸钠的氧化性强于碘(I2)在淀粉碘化钾溶液中加入少量NaClO2溶液,并加入少量的稀硫酸,溶液变蓝说明亚氯酸钠的氧化性强于碘

4.某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
①写出II实验中发生反应的离子方式:H++CH3COO-=CH3COOH.
②根据实验发现只要有气体、沉淀、弱电解质等物质生成,水溶液中复分解型离子反应就可以发生.
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些离子浓度减小 的方向进行(与溶液混合的瞬间相比).
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题.请你结合化学反应原理的相关知识对③中的结论作出合理解释:当生成上述三类物质时,形成新的化学键而导致体系的焓减或生成气体而导致熵增,由化学反应进行的方向的焓判据和熵判据知,反应可发生.
(2)如何研究H2SO4、KC1、NaHSO4、NaN03、Na2C03、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验,具体如下:
①根据方案进行分类时,经实验测得KC1、NaN03,溶液的pH=7;
H2SO4、NaHSO4、NH4Cl溶液的pH<7;
Na2C03、NaOH溶液的pH>7.
由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由.不合理、硫酸氢钠和氯化铵都属于盐,前者电离产生的阳离子除了氢离子还有钠离子,后者是因为水解而显酸性.
②向NaHS04、NaN03的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:2NO3-+3S2-+8H+=2NO↑+3S↓+4H2O.反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为0.075mol,转移电子的物质的量为0.15mol.
③某同学在用H2S04鉴别NaN03、Na2C03、NaOH溶液时,Na2C03很容易鉴别,但鉴别NaN03和NaOH时却陷入了困境.限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mlCuSO4溶液的试管里加入2mlNaOH溶液,观察现象 | Cu2++2OH-═Cu(OH)2↓ |
| Ⅱ.向盛有2mL pH=1的HCl溶液的试管里慢慢滴入18mL(已足量)CH3COONH4溶液(查资料知CH3COONH4,溶液呈中性 )震荡摇匀,测得pH≈3.7 | |
| Ⅲ向盛有2mLNaHCO3溶液的试管里加入2mL H2SO4溶液,观察现象 | HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
| Ⅳ向盛有2mL 稀Na2SO4溶液的试管里加入2mL稀KCl溶液,观察无明显现象 |  |
②根据实验发现只要有气体、沉淀、弱电解质等物质生成,水溶液中复分解型离子反应就可以发生.
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些离子浓度减小 的方向进行(与溶液混合的瞬间相比).
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题.请你结合化学反应原理的相关知识对③中的结论作出合理解释:当生成上述三类物质时,形成新的化学键而导致体系的焓减或生成气体而导致熵增,由化学反应进行的方向的焓判据和熵判据知,反应可发生.
(2)如何研究H2SO4、KC1、NaHSO4、NaN03、Na2C03、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验,具体如下:
①根据方案进行分类时,经实验测得KC1、NaN03,溶液的pH=7;
H2SO4、NaHSO4、NH4Cl溶液的pH<7;
Na2C03、NaOH溶液的pH>7.
由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由.不合理、硫酸氢钠和氯化铵都属于盐,前者电离产生的阳离子除了氢离子还有钠离子,后者是因为水解而显酸性.
②向NaHS04、NaN03的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:2NO3-+3S2-+8H+=2NO↑+3S↓+4H2O.反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为0.075mol,转移电子的物质的量为0.15mol.
③某同学在用H2S04鉴别NaN03、Na2C03、NaOH溶液时,Na2C03很容易鉴别,但鉴别NaN03和NaOH时却陷入了困境.限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
9.下列有关用标准浓度的氢氧化钠溶液滴定未知食醋浓度的相关说法不正确的是( )
| A. | 实验必需仪器有滴定管、锥形瓶、滴定管夹架台 | |
| B. | 若选择甲基橙作指示剂,则测得食醋中CH3COOH浓度偏高 | |
| C. | 滴定之前的操作是选滴管、检漏、水洗、润洗、装液、调液面、读数 | |
| D. | 开始俯视读数,终点时仰视读数,测得食醋中CH3COOH浓度偏高 |

 .
.