题目内容
18.(1)71g某物质Na2XO4中含钠离子的个数约为6.02×1023,写出该物质的化学式为Na2SO4.(2)在60g碳中,所有碳原子的最外层电子数共约为20NA 个,质子的总数约为30NA 个.
(3)483gNa2SO410H2O中所含的Na+的物质的量为3molmol,所含水分子数目约为15NA个.
分析 (1)根据钠离子的个数结合物质的构成可计算Na2XO4的物质的量,根据M=$\frac{m}{n}$计算Na2XO4的摩尔质量,可确定X的相对原子质量,确定元素的种类,可确定物质的化学式;
(2)先根据质量求出物质的量,然后结合1个碳原子的最外层电子数为4,质子数为6进行计算;
(3)根据n=$\frac{m}{M}$计算出483gNa2SO4•10H2O的物质的量,再根据晶体的化学式组成计算出钠离子的物质的量、水的分子数.
解答 解:(1)n(Na+)=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}}$=1mol,则n(Na2XO4)=0.5mol,M(Na2XO4)=$\frac{71g}{0.5mol}$=142g/mol,可知X的相对原子质量为142-2×23-4×16=32,应为S元素,
则该物质为Na2SO4,
故答案为:Na2SO4;
(2)60g碳的物质的量为$\frac{60g}{12g/mol}$=5mol,所含碳原子的最外层电子数目共为5mol×4×NA/mol=20NA;质子的总数目为5mol×6×NA/mol=30NA,
故答案为:20NA;30NA;
(3)483g Na2SO4•10H2O的物质的量为:n=$\frac{m}{M}$=$\frac{483g}{322g/mol}$=1.5mol,根据晶体的组成可知,n(Na+)=2n(Na2SO4•10H2O)=2×1.5mol=3mol;n(H2O)=10n(Na2SO4•10H2O)=10×1.5mol=15mol,N=nNA=15NA,
故答案为:3mol;15NA.
点评 本题考查物质的量的相关计算,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,题目难度不大.

| A. | 实验必需仪器有滴定管、锥形瓶、滴定管夹架台 | |
| B. | 若选择甲基橙作指示剂,则测得食醋中CH3COOH浓度偏高 | |
| C. | 滴定之前的操作是选滴管、检漏、水洗、润洗、装液、调液面、读数 | |
| D. | 开始俯视读数,终点时仰视读数,测得食醋中CH3COOH浓度偏高 |
| A. | 任何气体单质在标准状况下体积约为22.4L,则含有2NA个原子 | |
| B. | 常温常压下,16g氧气和32 g臭氧(O3)所含氧原子总数为3NA | |
| C. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3mol二氧化碳中含有氧原子数0.3NA |
 铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )
铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )| A. | 闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气 | |
| B. | 若将两U形管中的溶液混合,混合液的质量分数仍为30% | |
| C. | 若再单独闭合S2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小 | |
| D. | 若再单独闭合S2,E、F电极上发生的反应与之前相同 |
| A. | 单质的颜色逐渐加深 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 单质的密度逐渐减小 | D. | 单质在水中的溶解度逐渐增大 |
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 用硫酸铜溶液吸收硫化氢气体:Cu2++S2-═CuS↓ | |
| C. | 稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | NaOH溶液 |

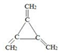 .
.