题目内容
13.在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)═2CO2(g)+N2(g).起始反应时NO和CO各为4mol,10s后达到化学平衡,测得N2为1mol.下列有关说法中正确的是( )| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
分析 A.该反应为气体体积减小的反应,增大压强,平衡正向移动;
B.10s后达到化学平衡,测得N2为1mol,结合反应可知转化的CO为2mol,结合v=$\frac{△c}{△t}$计算;
C.密闭容器的体积不变,n与p成正比;
D.往容器中充入1 mol O2,与NO反应,反应物浓度减小.
解答 解:A.该反应为气体体积减小的反应,增大压强,平衡正向移动,则N2的体积分数增大,故A错误;
B.10s后达到化学平衡,测得N2为1mol,结合反应可知转化的CO为2mol,10s内v(CO)=$\frac{△c}{△t}$=$\frac{\frac{2mol}{2L}}{10s}$=0.1 mol•L-1•s-1,前5s内浓度大,反应速率大于0.1mol•L-1•s-1,故B错误;
C.密闭容器的体积不变,n与p成正比,未达到平衡时压强在减小,则10s达到平衡时密闭容器中压强维持不变,故C正确;
D.往容器中充入1 mol O2,与NO反应,反应物浓度减小,平衡逆向移动,瞬间逆反应速率不变、正反应速率减小,故D错误;
故选C.
点评 本题考查化学平衡,为高频考点,把握平衡移动、速率计算、平衡特征为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
3.下列说法中错误的是( )
| A. | Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质 | |
| B. | 水溶液中,1 mol KCl比1 mol KClO3电离出的Cl-多 | |
| C. | NH3溶于水后,溶液能够导电,但NH3是非电解质 | |
| D. | NaHSO4溶于水电离方程式为NaHSO4═Na++H++SO42- |
4.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
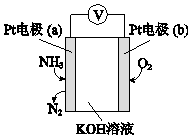

| A. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| B. | 电极a的反应式为2NH3-6e-+6OH-═N2+6H2O | |
| C. | O2在电极b上发生还原反应 | |
| D. | 溶液中OH-向电极a移动 |
1.25℃时,某浓度的氯化铵溶液的pH=4,下列叙述中不正确的是( )
| A. | 溶液中水电离出的c(OH-)=1×10-10 mol•L-1 | |
| B. | 溶液中的c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 溶液中的c(H+)+c(NH4+)=c(Cl-)+c(OH-) | |
| D. | 溶液中的c(NH3•H2O)=c(NH4+) |
18.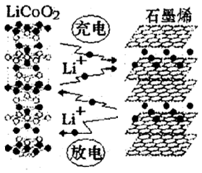 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
 2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )
2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 $?_{充电}^{放电}$C6+LiCoO2,其工作原理如图.下列关于该电池的说法正确的是( )| A. | 该电池若用隔膜可选用质子交换膜 | |
| B. | 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-═Li1-xCoO2+xLi+ | |
| C. | 石墨烯电池的优点是提高电池的储铿容量进而提高能量密度 | |
| D. | 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收 |
5.下列说法正确的是( )
| A. | HCOOCH3和CH3CHO表示同一种物质 | |
| B. | C2H5OH在NaOH水溶液中加热,可发生消去反应生成乙烯 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 蛋白质遇到浓硝酸,得到黄色沉淀 |
2.氯化亚铜(CuCl,白色、易氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等.工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如图:
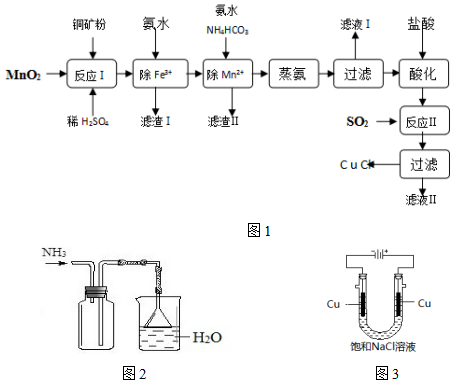
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O(未配平)
氧化产物为:CuSO4、S
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液.Cu(OH)2+4NH3?[Cu(NH3)4]2++2OH-
蒸氨条件及蒸氨效果见表
由表中信息可知蒸氨的条件应选c(填序号).蒸出的氨可以回收利用,在实验室用图2装置来收集当集气瓶收集满氨时观察到的现象是漏斗中的液面忽上忽下.
(4)反应Ⅱ的离子方程式SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+.
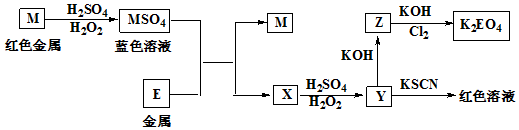
(5)实验证明通过图3装置也可获得CuCl,现象为
阴极:产生无色气体
阳极:有白色胶状沉淀生成且逐渐增多
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,
①生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓.
②有同学提出说:淡黄色沉淀可能是CuOH,以下是从资料中查阅到的有关CuOH信息,哪些可以支持该同学的说法bd.(填序号)
a.容易脱水变成红色的Cu2O.
b.CuOH是黄色或淡黄色固体,不溶于水
c.价格:240元/Kg
d.CuOH的Ksp=2×10-15
e.易被氧化成Cu(OH)2.

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O(未配平)
氧化产物为:CuSO4、S
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液.Cu(OH)2+4NH3?[Cu(NH3)4]2++2OH-
蒸氨条件及蒸氨效果见表
| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+.
(5)实验证明通过图3装置也可获得CuCl,现象为
阴极:产生无色气体
阳极:有白色胶状沉淀生成且逐渐增多
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,
①生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓.
②有同学提出说:淡黄色沉淀可能是CuOH,以下是从资料中查阅到的有关CuOH信息,哪些可以支持该同学的说法bd.(填序号)
a.容易脱水变成红色的Cu2O.
b.CuOH是黄色或淡黄色固体,不溶于水
c.价格:240元/Kg
d.CuOH的Ksp=2×10-15
e.易被氧化成Cu(OH)2.
 .
.