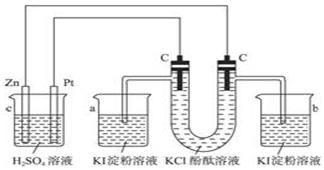
题目内容
3.下列说法中错误的是( )| A. | Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质 | |
| B. | 水溶液中,1 mol KCl比1 mol KClO3电离出的Cl-多 | |
| C. | NH3溶于水后,溶液能够导电,但NH3是非电解质 | |
| D. | NaHSO4溶于水电离方程式为NaHSO4═Na++H++SO42- |
分析 A.电解质:在水溶液里或熔融状态下能导电的化合物,该概念的前提条件是化合物;
B.KCl电离出K+和Cl-,KClO3电离K+和ClO3-;
C.NH3本身不能电离出离子,溶于水反应生成一水合氨电解质溶液导电;
D.NaHSO4为强电解质,在水溶液中完全电离.
解答 解:A.铜是单质,不是电解质,故A错误;
B.KCl电离出K+和Cl-,KClO3电离K+和ClO3-而不电离出Cl-,所以水溶液中,1 mol KCl比1 mol KClO3电离出的Cl-多,故B正确;
C.NH3本身不能电离出离子,溶于水反应生成一水合氨电解质溶液导电,属于非电解质,故C正确;
D.NaHSO4为强电解质,在水溶液中完全电离,则NaHSO4溶于水电离方程式为NaHSO4═Na++H++SO42-,故D正确.
故选A.
点评 本题考查电解质与非电解质以及物质的电离,抓住非电解质和电解质的特征是解题的关键,难度不大.

练习册系列答案
相关题目
20.向某溶液中加入AgNO3溶液有白色沉淀生成,过滤,向沉淀中加入足量稀HNO3,沉淀部分溶解,产生无色无味气体,将该气体通入澄清石灰水,石灰水变浑浊,由此判断该溶液中一定含有( )
| A. | Cl-、SO42- | B. | NO3-、CO32- | C. | Cl-、SO32- | D. | Cl-、CO32- |
1.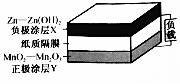 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )| A. | 放电电流由负极涂层经外电路流向正极涂层 | |
| B. | 充电时正极涂层与外接电源正极相连,发生还原反应 | |
| C. | 放电时每消耗65 g Zn通过纸质隔膜的电子为2 mol | |
| D. | 充电时阳极反应式为Mn2O3+2OH--2e-═2MnO2+H2O |
11.下列反应的离子方程式书写正确的是( )
| A. | 硫酸亚铁溶液中通入氯气 Fe2++Cl2═Fe3++Cl- | |
| B. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ | |
| C. | 石灰乳与稀盐酸反应OH-+H+═2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
18.下列实验操作中正确的是( )
| A. | 蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 | |
| B. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 焰色反应每次实验都要先用稀硫酸洗净铂丝 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
15.下列实验的现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 在AlCl3溶液中滴加过量氨水 | 有白色沉淀生成 | 实验室常用此法制备Al(OH)3 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化 | 滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
12.下列化学用语正确的是( )
| A. | 乙烯的分子式:CH2=CH2 | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: | D. | 1-丁烯分子的键线式: |
13.在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)═2CO2(g)+N2(g).起始反应时NO和CO各为4mol,10s后达到化学平衡,测得N2为1mol.下列有关说法中正确的是( )
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |