题目内容
8.根据下列框图回答问题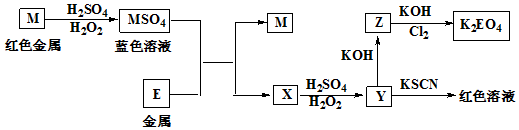
(1)M在潮湿的空气中易生成俗称为铜绿的物质.
(2)M溶于稀H2SO4和H2O2混合液生成MSO4的化学方程式为Cu+H2O2+H2SO4═CuSO4+2H2O.
(3)X加入稀H2SO4酸化的KMnO4溶液生成Y的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)Cl2将Z氧化为K2EO4时,每当生成1molK2EO4需要1.5molCl2.
分析 红色金属M为Cu,与硫酸、过氧化氢反应得到CuSO4,Y与KSCN反应得到血红色溶液,则Y含有Fe3+,结合转化关系,根据元素守恒可知,金属E为Fe,则X为FeSO4,Y为Fe2(SO4)3,Z为Fe(OH)3,氢氧化铁与氯气、KOH反应得到K2FeO4,根据电子转移守恒、原子守恒可知,还生成KCl、H2O,以此解答该题.
解答 解:(1)铜在潮湿的空气中易生成铜绿,故答案为:铜绿;
(2)金属铜在双氧水的氧化作用下和硫酸反应的方程式为:Cu+H2SO4+H2O2=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;
(3)X为FeSO4,具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)Z为Fe(OH)3,结合图中所示,方程式为:10KOH+3Cl2+2Fe(OH)3=2K2FeO4+6KCl+8H2O,由方程式可知每当生成1molK2EO4需要1.5mol氯气,
故答案为:1.5.
点评 本题考查的是无机的推断,为高频考点,做推断题首先要找到突破口,如本题中突破口是“M为红色金属,MSO4为蓝色溶液”,可以推知M为Cu.再结合题中所给出的信息一步一步往下分析、解答.推断题考查的内容较广,需要学生对无机物之间的反应熟练在心,才能迎刃而解.

练习册系列答案
相关题目
18.下列实验操作中正确的是( )
| A. | 蒸馏操作时,温度计水银球靠近蒸馏烧瓶的底部,且向蒸馏液体中加入几块沸石,以防止暴沸 | |
| B. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 焰色反应每次实验都要先用稀硫酸洗净铂丝 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
19.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 使石蕊变红色的溶液中:K+、Fe2+、Cl-、CH3COO- |
16.下列物质中属于非电解质的是( )
| A. | NaHCO3 | B. | Cl2 | C. | HNO3 | D. | CO2 |
3.下列对Na2CO3的分类,不正确的是( )
| A. | Na2CO3是有机物 | B. | Na2CO3是碳酸盐 | ||
| C. | Na2CO3是钠盐 | D. | Na2CO3是易溶性盐 |
13.在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)═2CO2(g)+N2(g).起始反应时NO和CO各为4mol,10s后达到化学平衡,测得N2为1mol.下列有关说法中正确的是( )
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
20.下列关于元素周期表的叙述中正确的是 ( )
| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
17.为除去括号内的杂质,下列所选用的试剂或方法不正确的是( )
| A. | SO2(HCl),将混合气体经饱和NaHSO3溶液洗气后干燥 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
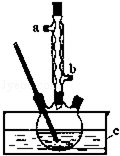 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为: