题目内容
2.氯化亚铜(CuCl,白色、易氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等.工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如图: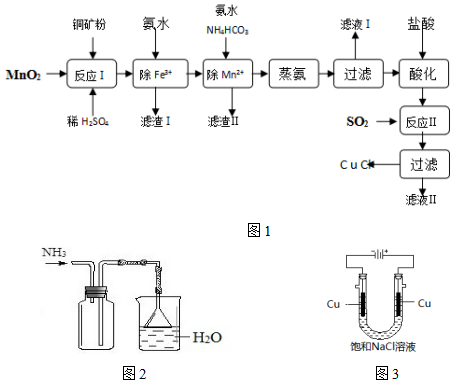
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O(未配平)
氧化产物为:CuSO4、S
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液.Cu(OH)2+4NH3?[Cu(NH3)4]2++2OH-
蒸氨条件及蒸氨效果见表
| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+.
(5)实验证明通过图3装置也可获得CuCl,现象为
阴极:产生无色气体
阳极:有白色胶状沉淀生成且逐渐增多
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,
①生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓.
②有同学提出说:淡黄色沉淀可能是CuOH,以下是从资料中查阅到的有关CuOH信息,哪些可以支持该同学的说法bd.(填序号)
a.容易脱水变成红色的Cu2O.
b.CuOH是黄色或淡黄色固体,不溶于水
c.价格:240元/Kg
d.CuOH的Ksp=2×10-15
e.易被氧化成Cu(OH)2.
分析 以初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备氯化亚铜的路线为:在反应I中向铜矿粉中加入硫酸溶液、二氧化锰,发生氧化还原反应生成硫单质,二氧化锰被还原为二价锰离子留在溶液中,溶液中含有铜离子、铁离子;向溶液中加入氨水,沉淀铁离子为氢氧化亚铁,过滤,滤渣Ⅰ是Fe(OH)3和单质硫的混合物,然后滤液中加入碳酸氢铵除锰离子,二价锰离子转化为碳酸锰沉淀,然后蒸氨得到氢氧化铜沉淀,发生分解反应得到CuO固体、氨气与二氧化碳,再用盐酸溶解CuO得到CuCl2,通入二氧化硫气体得到氯化亚铜沉淀,以此解答该题.
解答 解:(1)化合价升高的元素发生氧化反应,该元素所在的物质为氧化产物,该反应中Cu2S中硫元素化合价升高生成S单质,铜元素化合价由+1升高到+2的硫酸铜,故硫酸铜和S为氧化产物;
故答案为:CuSO4、S;
(2)除Mn2+时得MnCO3沉淀,反应的离子方程式为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
(3)由表可知,C中时间较短,蒸氨效果较好;蒸出的氨可以回收利用,在实验室用图2装置来收集当集气瓶收集满氨时,氨气极易溶于水,使漏斗中气压减小,液面上升,上升后,漏斗与烧杯中液体分离,液面又下降,故现象是漏斗中的液面忽上忽下;
故答案为:C;漏斗中的液面忽上忽下;
(4)反应Ⅱ为二氧化硫与铜离子反应生成CuCl沉淀的反应,离子方程式为:SO2+2Cu2++2Cl-+2H2O=2 CuCl↓+SO42-+4H+;
故答案为:SO2+2Cu2++2Cl-+2H2O=2 CuCl↓+SO42-+4H+;
(5)①该电解池中阴极水中的氢离子得电子,阳极由铜电极失去电子结合氯离子生成CuCl沉淀,生成CuCl的电极反应式为:Cu-e-+Cl-=CuCl↓;
故答案为:Cu-e-+Cl-=CuCl↓;
②靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,淡黄色沉淀可能是CuOH,说明CuOH是黄色或淡黄色固体,不溶于水,
Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=2×10-15,说明CuOH的溶解度较之CuCl的溶解度更小,可能为CuCl沉淀转化为CuOH沉淀;
故答案为:bd.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的运用等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 乙烯的分子式:CH2=CH2 | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: | D. | 1-丁烯分子的键线式: |
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
| A. | H2SO4 | B. | C60 | C. | NH3 | D. | Fe |
| A. | SO2(HCl),将混合气体经饱和NaHSO3溶液洗气后干燥 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
| A. | 工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 | |
| B. | 工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 | |
| C. | 工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 | |
| D. | 工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得 |
| A. | 将塑料废弃物加工成防水材料或汽油,变废为宝 | |
| B. | 煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化 | |
| C. | 食品添加剂必须用天然物质制造 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| A. | NO | B. | Ca(ClO)2 | C. | NaCl | D. | NaHCO3 |
 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.