题目内容
10.可以把5种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液一一区分的试剂是( )| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
分析 乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,Na2CO3溶液与氯化铁相互促进水解生成沉淀和气体,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,现象各不相同,以此来解答.
解答 解:A.乙醇、KOH溶液等不与新制碱性Cu(OH)2悬浊液反应,现象相同,不能鉴别,故A不选;
B.乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,Na2CO3溶液与氯化铁相互促进水解生成沉淀和气体,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,现象各不相同,可鉴别,故B选;
C.乙醇、苯酚、KOH溶液等不与氯化钡溶液反应,现象相同,不能鉴别,故C不选;
D.乙醇、苯酚均可被酸性高锰酸钾氧化,使其褪色,现象相同,不能鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别,题目难度较大,把握物质的性质与反应现象为解答本题的关键,涉及的反应较多,注意氧化还原反应及相互促进水解反应为解答的难点,要注意总结和积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中氧化剂是MnO4-.(填化学式)
(2)对比实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验Ⅰ和Ⅲ.
(3)对比实验Ⅰ和Ⅳ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其它物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | / |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验Ⅰ和Ⅱ(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验Ⅰ和Ⅲ.
(3)对比实验Ⅰ和Ⅳ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同.
1.表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置.试用元素符号、离子符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar(填元素符号).
(2)③④⑤三种元素最高价氧化物对应水化物中,碱性最强的是Ca(OH)2(填化学式),该物质含有的化学键类型是离子键和共价键.
(3)元素⑦的氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)①和⑦两元素形成四核化合物的电子式是 .
.
(5)元素⑧与元素⑨相比,非金属性较强的是Cl>S(用元素符号表示),下列表述中能证明这一事实的是bd(填序号).
a.与金属化合时,每个硫原子比每个氯原子得电子数多
b.⑨的氢化物比⑧的氢化物稳定
c.一定条件下⑧和⑨的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物酸性⑨比⑧强
(6)元素②的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
(2)③④⑤三种元素最高价氧化物对应水化物中,碱性最强的是Ca(OH)2(填化学式),该物质含有的化学键类型是离子键和共价键.
(3)元素⑦的氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)①和⑦两元素形成四核化合物的电子式是
 .
.(5)元素⑧与元素⑨相比,非金属性较强的是Cl>S(用元素符号表示),下列表述中能证明这一事实的是bd(填序号).
a.与金属化合时,每个硫原子比每个氯原子得电子数多
b.⑨的氢化物比⑧的氢化物稳定
c.一定条件下⑧和⑨的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物酸性⑨比⑧强
(6)元素②的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+H2O.
5.下列有机物中能使酸性KMnO4溶液褪色,但不能使溴水因发生反应而褪色的是( )
①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
| A. | 只有⑤ | B. | ⑤⑥ | C. | ①④⑧ | D. | ②③⑤⑦ |
2.下列既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片与稀盐酸反应 | B. | 氢氧化钡与氯化铵的反应 | ||
| C. | 灼热的碳与水蒸气的反应 | D. | 铝热反应 |
20.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
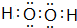 ,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程
,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程 .
.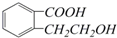 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: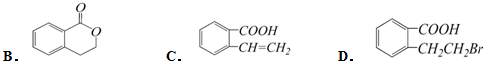
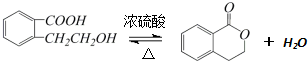 .
.