题目内容
20.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
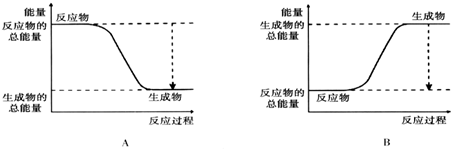
(2)如图能正确表示该反应中能量变化的是A.
(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

分析 (1)增大反应物浓度、使用催化剂、升高温度等均可加快反应速率;
(2)放热反应中反应物的总能量大于生成物的总能量;
(3)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(4)原电池反应是自发进行的放热的氧化还原反应,该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,以此解答.
解答 解:(1)A.使用催化剂,加快反应速率,故A选;
B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
故答案为:ABC;
(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,
故答案为:A;
(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,△H=反应物中键能之和-生成物中键能之和=1368-1852=-484<0,该反应为放热反应.
故答案为:
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化 | |
| 拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | 放出热量 | 1852 |
| 总能量变化 | 放出热量 | 484 | |
(4)原电池反应是自发进行的放热的氧化还原反应,A中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,B中Fe元素化合价发生变化,所以可以设计成原电池,该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液;
故答案为:B;
 .
.点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
10.据最新报道:用10B合成的10B20分子由非常好的抗癌作用,下列说法正确的是( )
| A. | 10B的质子数是10 | B. | 10B20是一种新合成的化合物 | ||
| C. | 10B的中子数与核外电子数相同 | D. | B元素位于元素周期表中的第三列 |
11.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述不正确的是( )
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
8.重水(21D2O)是重要的核工业原料,下列说法错误的是( )
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
15.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变.
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
5.下列有机物中能使酸性KMnO4溶液褪色,但不能使溴水因发生反应而褪色的是( )
①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
| A. | 只有⑤ | B. | ⑤⑥ | C. | ①④⑧ | D. | ②③⑤⑦ |
12.胡椒粉是植物挥发油的成分之一.它的结构式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1 mol胡椒粉最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒粉最多可与3 mol溴水发生反应 | |
| C. | 胡椒粉可与氯化铁溶液反应,使溶液呈紫色 | |
| D. | 胡椒粉与NaHCO3溶液反应产生CO2 |
9.下列说法正确的是( )
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、Na+、SO42-、Br- | |
| B. | pH=1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 能使石蕊变红的溶液:Cu2+、Na+、AlO2-、Cl- | |
| D. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、Cl- |