题目内容
5.氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O $\frac{\underline{\;激光\;}}{TiO_{2}}$2H2↑+O2↑.试回答下列问题:(1)分解海水的反应属于吸热反应(填“放热”或“吸热”).
(2)在化工生产中氢气也是生产盐酸的重要原料,已知断开1mol H2中的化学键需吸收436kJ的热量,断开1mol Cl2中的化学键需吸收243kJ的热量,而断开1mol HCl分子中的化学键吸收431kJ的热量,写出H2和Cl2反应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol.
(3)在许多领域已广泛使用氢氧燃料电池,它可以使用多种物质作为电解质.其中一种用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2--4e-═2H2O B极:O2+4e-═2O2-
则B极是电池的正极;如果使用KOH溶液作为电解质,写出负极的电极反应2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O).
分析 (1)水在催化剂和激光条件下分解,吸收能量;
(2)反应的反应热=拆化学键吸收的能量-形成化学键放出的能量,以此书写热化学方程式;
(3)B极氧气得电子被还原,如果使用KOH溶液作为电解质,负极上氢气失去电子生成水.
解答 解:(1)水在催化剂和激光条件下分解,吸收能量,为吸热反应,故答案为:吸热;
(2)反应热=断裂化学键吸收的能量-形成化学键放出的能量=436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183kJ/molKJ,所以H2与Cl2反应的热化学方程式为 H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
(3)B极氧气得电子被还原,为正极反应,如果使用KOH溶液作为电解质,负极上氢气失去电子生成水,电极方程式为2H2+4OH--4e-=4H2O (或H2+2OH--2e-=2H2O ),
故答案为:正;2H2+4OH--4e-=4H2O (或H2+2OH--2e-=2H2O ).
点评 本题考查化学电源新型电池以及原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极反应,题目难度不大,本题注意基础知识的积累.

练习册系列答案
相关题目
16.下列叙述不正确的是( )
| A. | 低碳生活(low-carbon life)是一种时尚的生活理念,倡导减少温室气体排放,CO2、CH4等是常见的温室气体 | |
| B. | 新型无机非金属材料用途广泛,人造刚玉用做高温炉管、氮化硅陶瓷可用于制造柴油机发动机部件 | |
| C. | 推广可利用太阳能、风能的城市照明系统,积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料,利于发展低碳经济、循环经济 | |
| D. | “显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为126g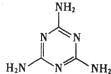 |
13.下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 利用A装置,若A为浓醋酸、B为碳酸钠(粉状)、C为苯酚钠溶液,一定能验证醋酸、碳酸、苯酚酸性的强弱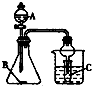 | |
| B. | 利用B装置可以完成乙酸乙酯制取实验 | |
| C. | 利用C装置可以完成石油蒸馏 | |
| D. | 利用D装置可以完成实验室制乙烯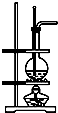 |
10.某有机物的分子式为C9H12,其属于芳香烃的同分异构体有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
17.某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线.当玻璃被击碎时,与金属线相连的警报系统就会立即报警.“防盗玻璃”能报警是利用了金属的( )
| A. | 延展性 | B. | 导电性 | C. | 弹性 | D. | 导热性 |
4.某同学用Na2CO3配制0.10mol/L Na2CO3(aq)的过程如图所示.你认为该同学的错误有( )

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
 (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)