题目内容
15.1mol Cl2参加反应转移电子数一定为2NA.× (判断对错)分析 氯气参加反应,表现性质不同,转移电子数不同,据此判断.
解答 解:氯气参加反应,表现性质不同,转移电子数不同,例如氯气与水反应生成盐酸和次氯酸,Cl元素的化合价由0升高为+1价,Cl元素的化合价由0降低为-1价,1mol Cl2参加反应转移电子数为NA;
1mol Cl2与铁反应生成氯化铁,氯气全部做氧化剂,1mol Cl2参加反应转移电子数为2NA;
所以1mol Cl2参加反应转移电子数不一定为2NA.
故错误.
点评 本题考查了氧化还原反应得失电子数目计算,明确氯气表现性质是解题关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
6.NA代表阿伏加德罗常数.下列有关NA的叙述中,不正确的是( )
| A. | 1 mol 任何气体所含的分子数均为NA | |
| B. | 14 g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为NA |
7.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 46gC2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将15.6gNa2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| D. | 2molSO2和1molO2混合,所得气体的分子数为2NA |
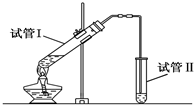 实验室用如图所示装置制备少量乙酸乙酯.
实验室用如图所示装置制备少量乙酸乙酯. .
.