题目内容
18.从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化.(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是c(填字母
序号).
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示.整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行.
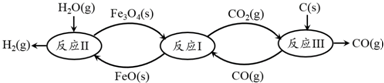
①已知:Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
C(s)+CO2(g)?2CO(g)△H3═+172.4kJ•mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5kJ•mol-1.
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系.
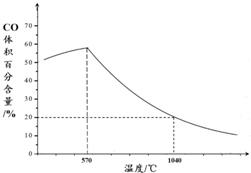
i.反应Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H<0(填“>”、“<”或“=”),理
由是当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)逆向移动,故△H<0.
ii.随温度升高,反应Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)平衡常数的变化趋势是增大;1040℃时,该反应的化学平衡常数的数值是4.
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓.
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
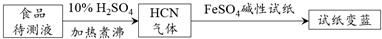
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色.
分析 (1)天然磁石成分为四氧化三铁;
(2)①Ⅰ.Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)?2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;
②i.图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,结合三行计算列式计算得到平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀;
②若试纸变蓝则证明食品中含有CN-,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色.
解答 解:(1)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁,选c,
故答案为:c;
(2)①Ⅰ.Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H1═+19.3kJ•mol-1
Ⅱ.3FeO(s)+H2O(g)?Fe3O4(s)+H2(g)△H2═-57.2kJ•mol-1
Ⅲ.C(s)+CO2(g)?2CO(g)△H3═+172.4kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ+Ⅲ得到铁氧化物循环裂解水制氢气总反应的热化学方程式;C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ,
故答案为:C(s)+H2O(g)═H2(g)+CO(g)△H═+134.5 kJ•mol-1 ;
②i.当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行,图象分析可知,随温度升高CO体积分数增大,说明达到平衡状态后,升温平衡逆向进行,正反应为放热反应,△H<0,
故答案为:<;当其他条件一定时,温度升高,CO的体积百分含量增大,可逆反应Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g) 逆向移动,故△H<0;
ii.高于570°C,随温度升高,反应Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)平衡正向进行,平衡常数的变化趋势增大,1040℃时CO体积分数为20%,结合三行计算列式计算得到平衡浓度,设起始浓度CO为1mol/L,消耗CO浓度为x
Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)
起始量(mol/L) 1 0
变化量(mol/L) x x
平衡量(mol/L) 1-x x
$\frac{1-x}{1}$=20%
x=0.8mol/L
K=$\frac{0.8}{1-0.8}$=4,
故答案为:增大; 4;
(3)①[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓,
故答案为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓;
②基于普鲁士蓝合成原理可检测食品中CN-,碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色,
故答案为:碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色.
点评 本题考查了物质性质、热化学方程式书写、离子检验实验设计方案分析判断、化学平衡计算等知识点,注意题干信息的理解应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
实验Ⅰ:将Fe3+转化为Fe2+(如图)
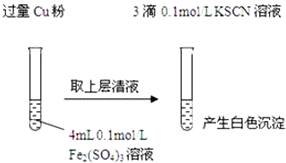
(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓(白色)+I2
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液或者KMnO4,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
| A. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
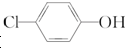 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )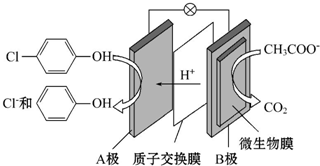
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 用足量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3•H2O=NH4++HSO3- |

