题目内容
11.将4.6g钠投入水中充分反应,再向反应所得溶液中加入6mol/LAlCl3溶液10mL,求:(1)钠与水反应产生的气体的体积(标准状况下);
(2)反应所得沉淀的物质的量.
分析 钠与水发生反应2Na+2H2O=2NaOH+H2↑,n(NaOH)=n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,n(AlCl3)=0.01L×6mol/L=0.06mol,发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,以此来解答.
解答 解:(1)n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,由2Na+2H2O=2NaOH+H2↑可知,生成气体的体积为0.2mol×$\frac{1}{2}$×22.4L/mol=2.24L,
答:钠与水反应产生的气体的体积为2.24L;
(2)n(NaOH)=n(Na)═0.2mol,n(AlCl3)=0.01L×6mol/L=0.06mol,发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,则
Al3++3OH-=Al(OH)3↓、
0.06 0.18 0.06
Al(OH)3+OH-=AlO2-+2H2O
0.02 0.02
可知沉淀为0.06mol-0.02mol=0.04mol,
答:反应所得沉淀的物质的量为0.04mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
2.某混合物X由Na2O、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校兴趣小组以两条途径分别对X进行如下实验探究.

下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
19.海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
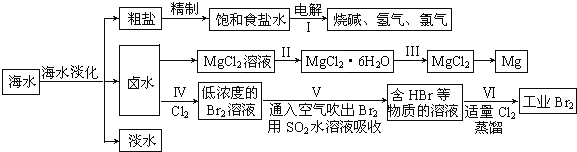
(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).
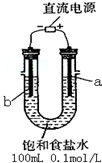
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是ad(填序号,下同),加入e调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(三)制取工业溴:
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.

(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).

(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| B. | 2.3 g钠在足量的氧气中燃烧,钠失去的电子数为0.2NA | |
| C. | 标准状况下,2g氢气所含原子数目为NA | |
| D. | 100mL0.2mol/L BaCl2溶液中Cl-的数目为0.02NA |
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
3.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红、红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列说法正确的是( )
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
1. (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
①该反应的化学方程式:Y+2Z?3X
②反应开始至2min末,X的反应速率为$\frac{1}{15}$mol/(L•min).
③该反应是由正逆反应同时开始反应的.(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
①该反应的平衡常数表达式为$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;从表中分析:c1<c2,
c3=c4(填“>”、“<”或“=”).
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为0.001mol•L-1•s-1.
③达平衡后下列条件的改变可使NO2气体浓度增大的是B(填字母序号).
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为25%.
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:①该反应的化学方程式:Y+2Z?3X
②反应开始至2min末,X的反应速率为$\frac{1}{15}$mol/(L•min).
③该反应是由正逆反应同时开始反应的.(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
c3=c4(填“>”、“<”或“=”).
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为0.001mol•L-1•s-1.
③达平衡后下列条件的改变可使NO2气体浓度增大的是B(填字母序号).
A.扩大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
④若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为25%.


