题目内容
12.下列实验相关叙述正确的是( )| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 实验室常采用铁屑、溴水、苯混合制溴苯 | |
| C. | 苯中含有少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 | |
| D. | 一定物质的量浓度溶液的配置必须要用干燥的容量瓶,否则有误差 |
分析 A.Cu与氧气反应生成CuO,CuO可氧化乙醇生成乙醛、Cu、水;
B.苯与溴水不反应;
C.溴、三溴苯酚均易溶于苯;
D.容量瓶不需要干燥.
解答 解:A.将铜丝在酒精灯上加热后,Cu与氧气反应生成CuO,立即伸入无水乙醇中,CuO可氧化乙醇生成乙醛、Cu、水,则铜丝恢复成原来的红色,故A正确;
B.苯与溴水不反应,实验室常采用铁屑、液溴、苯混合制溴苯,故B错误;
C.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液法除杂,故C错误;
D.容量瓶不需要干燥,定容前及定容时均需加蒸馏水,则容量瓶中原来有水对溶液配制无影响,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、有机物的制备、混合物分离提纯、溶液配制等,把握有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
3.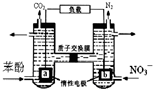 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是:( )| A. | a为正极 | |
| B. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| C. | 左池电极反应式为C6H6O+11H2O-28e-═6CO2↑+28H+ | |
| D. | 左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
7.关于金属锂的叙述中,错误的是( )
| A. | 与水反应时,比钠更剧烈 | B. | 它的原子半径比钠的小 | ||
| C. | 它是密度最小的碱金属 | D. | 它可以做还原剂 |
17.下列叙述中正确的是(NA为阿伏加德罗常数)( )
| A. | 1.7 g的羟基中含有的电子数为NA | |
| B. | 标准状况下,11.2 L四氯化碳所含的原子数为2NA | |
| C. | 常温常压下,18 g H2O含有的原子数为3NA | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2NA |
4.A元素原子的L电子层比B元素原子的L电子层少3个电子,B元素原子核外总电子数比A元素原子电子总数多5个,则A、B形成化合物可能是( )
| A. | 离子化合物AB | B. | 离子化合物B2A3 | C. | 离子化合物B(AO3)2 | D. | 离子化合物A2BO3 |
1.列有关化学用语表达不正确的是( )
| A. | 氨气分子的电子式: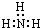 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |
2.如表为元素周期表短周期的一部分,请用化学用语(元素符号或化学式)回答相关问题:
(1)⑥元素在周期表中的位置为第三周期第ⅢA族.
(2)表中序号元素中半径最大的常见离子是S2-.
(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)
A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性
C.通过和铁反应,比较得电子能力 D.通过置换反应
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式 .
.
(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)表中序号元素中半径最大的常见离子是S2-.
(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)
A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性
C.通过和铁反应,比较得电子能力 D.通过置换反应
(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式
 .
.(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
 ;KCl第电子式
;KCl第电子式 .
.