题目内容
19.写出二氧化硫和水合氢离子中硫原子,氧原子分别采用sp2和sp3杂化形式,其空间构型分别为V形和三角锥型.分析 计算氧原子的价层电子数与氧原子的孤对电子对数,判断杂化方式与水合氢离子的空间构型,计二氧化硫中硫原子的价层电子数与氧原子的孤对电子对数,确定其空间结构.
解答 解:二氧化硫分子中硫原子价层电子对2+$\frac{1}{2}$(6-2×2)=3,S原子采取sp2杂化,S原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+$\frac{1}{2}$(6-1-3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,
故答案为:sp2;sp3;V形;三角锥型.
点评 本题考查了分子或离子杂化类型和空间构型的判断,题目难度不大,注意把握中心原子的价层电子对数的计算方法.

练习册系列答案
相关题目
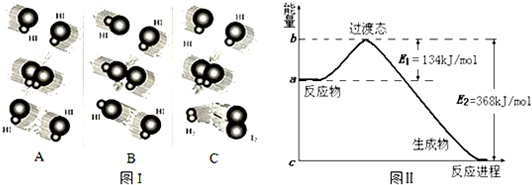
9.常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
10.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,放电时的反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O下列结论正确的是( )
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
7.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 液氨汽化时吸热,可作制冷剂 | |
| B. | 氧化铝熔点高,可作耐火材料 | |
| C. | 利用酒精沸点较低,可作消毒杀菌剂 | |
| D. | 利用CO2合成的聚碳酸酯能水解,可作降解塑料 |
11.下列关于电解质导电性的说法中,正确的是( )
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
 氮气、氨及铵盐用途非常广泛.回答下列问题:
氮气、氨及铵盐用途非常广泛.回答下列问题: