题目内容
9.常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
分析 A.键能越大形成的化学键越稳定;
B.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
C.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析推断;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断.
解答 解:A.键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故A正确;
B.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)?△H=+436 kJ•mol-1 ,故B正确;
C.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析,所以结合图表中数据可知432 kJ•mol-1>E(H-Br)>298 kJ•mol-1,故C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436KJ/mol+157KJ/mol-2×568KJ/mol=-543KJ/mol,H2(g)+F2(g)=2HF(g)?△H=-543 kJ•mol-1,故D错误;
故选D.
点评 本题考查了化学反应能量变化和键能的关系分析判断,焓变计算方法是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.瑞士籍的厄希恩摩瑟(Eschenmoser)曾设计一套合成立体瑞士烷的方法,先合成象以色列国徽的大卫之星烷(israelane),加热可以得到立体瑞士烷(helvetane).以下叙述正确的是( )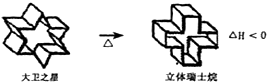

| A. | 立体瑞土烷的分子式为C24H26 | |
| B. | 大卫之星烷与立体瑞士烷的一氯代物均只有一种 | |
| C. | 大卫之星烷比立体瑞士烷更稳定 | |
| D. | 大卫之星烷与立体瑞士烷互为同分异构体 |
17.下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题:
(1)上述10种元素中,金属性最强的元素的元素符号是K,其单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)①③⑤三种元素最高价氧化物对应水化物中碱性最强的是(填化学式)NaOH.
(3)元素①和⑦点燃时形成的化合物的化学式为Na2O2.该化合物的焰色为黄色.该化合物溶液与元素⑧的单质反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是K+>Mg2+>Al3+.(用微粒符号表示)
(5)元素⑧的最高价氧化物的水化物的化学式为HClO4.
(6)下列能说明氯元素比硫元素非金属性强的是:②③④.(填序号)
①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸; ③S2-易被氯气氧化成S;
④氯化氢比硫化氢稳定; ⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①③⑤三种元素最高价氧化物对应水化物中碱性最强的是(填化学式)NaOH.
(3)元素①和⑦点燃时形成的化合物的化学式为Na2O2.该化合物的焰色为黄色.该化合物溶液与元素⑧的单质反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是K+>Mg2+>Al3+.(用微粒符号表示)
(5)元素⑧的最高价氧化物的水化物的化学式为HClO4.
(6)下列能说明氯元素比硫元素非金属性强的是:②③④.(填序号)
①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸; ③S2-易被氯气氧化成S;
④氯化氢比硫化氢稳定; ⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应.
14.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
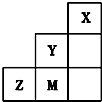

| A. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 稳定性:HY<HM | |
| D. | 非金属性:Y>M>Z |
18.分子式为C9H10O2的含有一价苯环的所有酯类同分异构体有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |


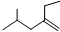 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯 .
.