题目内容
14.有CH4、C2H4、C3H4、C2H6、C3H65种烃,则:(1)等物质的量的上述五种烃完全燃烧生成CO2和H2O,消耗O2最多的是C3H6.
(2)等质量的上述5种烃完全燃烧生成CO2和H2O,消耗O2最多的是CH4.
(3)等质量的上述5种烃完全燃烧时生成CO2最多的是C3H4,生成H2O最多的是CH4.
(4)在120℃、1.01×105Pa的条件下,与足量O2混合点燃,完全燃烧后气体体积没有变化的是CH4、C2H4、C3H4(5种烃常温常压下均为气体).
分析 (1)燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),1mol烃的耗氧量为(x+$\frac{y}{4}$)mol;
(2)质量相同时,C元素质量分数越大生成二氧化碳越多,H元素质量分数越大生成水越多;
(3)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则反应前后气体总化学计量数不变.
解答 解:(1)1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,则等物质的量的CH4、C2H4、C3H4、C2H6、C3H6中消耗O2最多的是 C3H6,
故答案为:C3H6;
(2)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,CH4、C2H4、C3H4、C2H6、C3H6的H%大小为:CH4>C2H6>C3H6=C2H4>C3H4,故完全燃烧时消耗O2的量最多的是CH4,
故答案为:CH4;
(3)烃的质量相等时,碳的质量分数越大,完全燃烧时生成的CO2越多,CH4、C2H4、C3H4、C2H6、C3H6的C%大小为:CH4<C2H6<C3H6=C2H4<C3H4故完全燃烧生成的CO2最多的是C3H4;
质量相同时,分子中H元素的质量分数越大,分子中C元素的CH4、C2H4、C3H4、C2H6、C3H6的H%大小为:CH4>C2H6>C3H6=C2H4>C3H4,完全燃烧时生成H2O越多,故生成水最多的是CH4,
故答案为:C3H4;CH4;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,故y=4,即CH4、C2H4、C3H4完全燃烧后体积不变,
故答案为:CH4、C2H4、C3H4.
点评 本题考查烃燃烧有关规律,充分利用组成通式与对燃烧通式解答,侧重考查学生的分析计算能力,注意对规律的理解与掌握.

方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插
入一支温度计,温度计的温度由20℃逐渐升至75℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
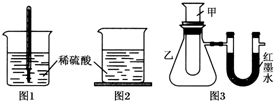
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)铝片与稀硫酸的反应是放热(填“吸热”或“放热”)反应,写 出该反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(2)方案一中,温度升至最大值后又下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(3)方案二中,小木片脱落的原因是蜡烛熔化,由此得出的结论是氢氧化钠与硫酸的反应放热.
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边低于(填“高于”“低于”或“等于”)右边.
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是红墨水液面左右相平.
(6)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
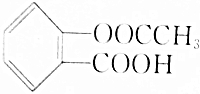 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
| A. | K+、Na+、Cl-、NO3- | B. | K+、Na+、Br-、SiO32- | ||
| C. | H+、Fe2+、SO42-、Cl2 | D. | K+、Ag+、NH3•H2O、NO3- |
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
| A. | 电池负极发生氧化反应 | |
| B. | 一般相对活泼的金属材料做电池的负极 | |
| C. | 电子流向是从负极流向正极(外电路) | |
| D. | 阳离子移向负极(内电路) |
 .
.