题目内容
12.下列说法正确的是( )| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
分析 A.反应是否加热与反应热无关;
B.反应物的总能量与生成物的总能量大小决定反应是放热反应还是吸热反应;
C.化学反应速率的大小主要取决于物质的性质;
D.催化剂不能改变平衡移动.
解答 解:A.凡需要加热的反应不一定为吸热反应,如铝热反应需在高温下进行,但为放热反应,故A错误;
B.如为放热反应,则反应物的总能量比生成物的总能量高,如为吸热反应,则反应物的总能量比生成物的总能量低,故B正确;
C.化学反应速率的大小主要取决于物质的性质,外界因素为次要因素,故C错误;
D.催化剂不能改变平衡移动,转化率不变,故D错误.
故选B.
点评 本题考查化学反应速率以及反应热与焓变等知识,为高频考点,侧重双基的考查,注意相关基础的积累,难度不大.

练习册系列答案
相关题目
2.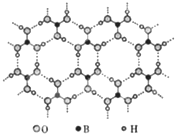 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
3.在实验室中,下列除去杂质的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液振荡 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中振荡,静置,分液 | |
| D. | 乙烯中混有SO2和CO2,将其通入酸性KMnO4溶液中洗气 |
7.实验室制取蒸馏水时,不需要用到的实验仪器是( )
| A. | 蒸发皿 | B. | 冷凝管 | C. | 圆底烧瓶 | D. | 酒精灯 |
17.碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:
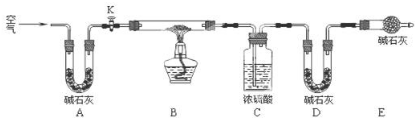
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.
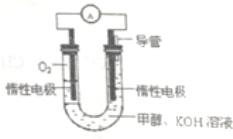 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国己计划将甲醇燃料电池用于军事目的.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在KOH电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.