题目内容
4.一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍,在此时间内V(H2)是( )mol/(L•min)| A. | 0.2 | B. | 0.6 | C. | 0.1 | D. | 0.3 |
分析 利用压强之比等于物质的量之比,求出3min后容器内混合气体的物质的量,据此通过方程式利用差量法计算氢气的物质的量变化量,再利用根据v=$\frac{△c}{△t}$计算v(H2).
解答 解:3min末测得容器内压强是起始时压强的0.9倍,压强之比等于物质的量之比,
所以3min末时容器内混合气体的物质的量为(1mol+3mol)×0.9=3.6mol
3H2+N2  2NH3△n
2NH3△n
3 2
△n(H2) 4mol-3.6mol=0.4mol
所以△n(H2)=$\frac{3}{2}$×0.4mol=0.6mol,
所以3min后,用H2表示的平均反应速率v(H2)=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min).
故选C.
点评 本题考查反应速率的有关计算,难度不大,关键根据压强变化计算参加反应的氢气的物质的量.

练习册系列答案
相关题目
15.下列化学用语正确的是( )
| A. | 羟基的电子式: | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为20的氯原子: | D. | 乙烯的分子式:CH2═CH2 |
12.下列说法正确的是( )
| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
19.下列关于 Na2CO3 和 NaHCO3 性质的比较中,正确的是( )
| A. | 等物质的量的固体与足量的盐酸反应放出CO2的质量:Na2CO3>NaHCO3 | |
| B. | 相同条件下,溶于水溶液的碱性:Na2CO3<NaHCO3 | |
| C. | 常温下,在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 相同条件下,与稀盐酸反应的快慢:Na2CO3>NaHCO3 |
9.下列叙述正确的是( )
| A. | 146C和167N的质子数相同,中子数不同 | |
| B. | 2814Si和2914Si的质子数相同,是同一种核素 | |
| C. | Na和K属于IA族元索,Na的金属性比K弱 | |
| D. | Cl和Br属于ⅧA族元素,两原子核外电子数之差为8 |
16.配制100mL2.0mol•L-1Na0H溶液时,不需要用到的仪器是( )
| A. |  烧杯 | B. |  玻璃棒 | C. |  容量瓶 | D. |  集气瓶 |
13.《新科学家》网站报道,科学家通过电解Fe2O3、SiO2、CaO的熔融液(1 600℃)制得了铁.若该方法用于工业上冶铁,与常规方法相比,下列说法错误的是( )
| A. | 大幅度降低能耗 | |
| B. | 电解时铁在阴极上析出 | |
| C. | 降低温室气体的排放 | |
| D. | 生成等量的铁时,此方法与热还原法转移的电子数相同 |
14.绿色化学追求减少化工生产对环境造成的污染,下列物质可以称为绿色氧化剂的是( )
| A. | 浓硫酸 | B. | 高锰酸钾 | C. | 双氧水 | D. | 漂白粉 |
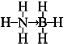 ;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).