题目内容
12.下列条件变化会使H2O的电离平衡向电离方向移动,且pH<7的是( )| A. | 常温下,向水中加少量稀盐酸 | B. | 将纯水加热到100℃ | ||
| C. | 常温下,向水中加少量Na | D. | 常温下,向水中加少量Na2CO3固体 |
分析 A.水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度;
B.水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+)增大,则pH减小;
C.向水中加少量Na,钠和水溶液中氢离子反应促进水的电离平衡正向进行,氢氧根离子浓度增大;
D.加入水解的盐会促进水的电离.
解答 解:A.向水中加少量HCl,氢离子浓度增大,抑制水的电离,平衡左移,溶液PH<7,故A不符合;
B.常温下水的PH=7,将纯水加热到100℃,水的电离平衡正向进行,氢离子浓度和氢氧根离子浓度增大,水的PH<7,故B符合;
C.向水中加少量Na,钠和水溶液中氢离子反应促进水的电离平衡正向进行,氢氧根离子浓度增大,溶液PH>7,故C不符合;
D.向水中加少量Na2CO3,碳酸根离子水解显碱性,促进水的电离右移,溶液PH>7,故D不符合;
故选B.
点评 本题考查了水的电离平衡影响因素的分析判断,加热促进水的电离,酸碱抑制电离,水解的盐促进水的电离,题目难度不大.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol乙基中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
3.下列说法中,正确的是( )
| A. | 糖类、蛋白质、橡胶、油脂都是天然高分子化合物 | |
| B. | 加热会使蛋白质变性,因此食生鸡蛋所获营养价值高 | |
| C. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
20.常温下,下列各组离子在溶液中一定能大量共存的是( )
| A. | Na+、Al3+、OH- | B. | Ba2+、NO3-、SO42- | C. | K+、Na+、NO3- | D. | K+、NH4+、OH- |
4.下列物质中既可通过氧化还原反应生成,又可通过复分解反应生成的是( )
| A. | Al2S3 | B. | SO2 | C. | H2SiO3 | D. | NO2 |
12.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次通过盛有下列哪一组试剂的洗气瓶( )
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | 浓H2SO4、NaOH溶液 |
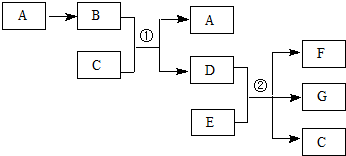
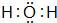 .
.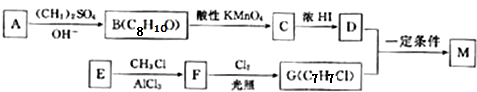
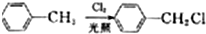
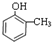 ;E→F的反应类型为取代反应;
;E→F的反应类型为取代反应;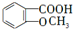 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$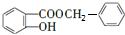 +HCl;
+HCl;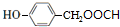 (写结构简式).
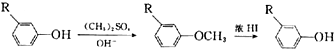
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备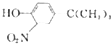 的合成路线
的合成路线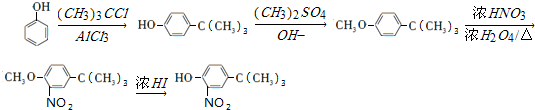 .
.