题目内容
实验室需要450mL 1mol?L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有 .
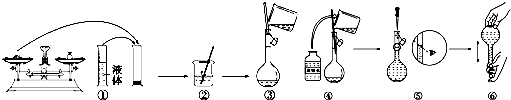
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是 (填操作序号).
(3)称取NaOH固体时,所需砝码的质量为 (填写字母)
A.18g B.20g C.18g~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)若定容摇匀后有少量溶液外流,则所配溶液的物质的量浓度 (填偏高、偏低或无影响).
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是

(3)称取NaOH固体时,所需砝码的质量为
A.18g B.20g C.18g~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)若定容摇匀后有少量溶液外流,则所配溶液的物质的量浓度
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答;
(3)根据n=cV、m=nM计算出500mL1.0mol/L 的NaOH溶液中含有溶质氢氧化钠的质量,然后根据氢氧化钠的称量要放到小烧杯里称量来分析;
(4)根据实验操作的方法分析;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答;
(3)根据n=cV、m=nM计算出500mL1.0mol/L 的NaOH溶液中含有溶质氢氧化钠的质量,然后根据氢氧化钠的称量要放到小烧杯里称量来分析;
(4)根据实验操作的方法分析;
(5)根据c=
| n |
| V |
解答:
解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
根据提供的仪器可知,还需仪器有500ml容量瓶、胶头滴管,
故答案为:胶头滴管、500mL容量瓶;
(2)①量筒为量取仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④加水至刻度线的下方,操作正确,故④正确;
⑤定容时,眼睛应平视刻度线,故⑤错误;
⑥加盖摇匀,使溶液混合均匀,操作正确,故⑥正确;
故答案为:①③⑤;
(3)由于无450mL的容量瓶,故选用500mL的容量瓶,配制出500mL的1.0mol/L的溶液,500mL 1.0mol/L的氢氧化钠溶液中含有溶质的质量为:m=1.0mol/L×0.5L×40g/mol=20g,需要称量的氢氧化钠的质量为20.0g,而称量氢氧化钠固体时,要放到小烧杯里称量,故选用的砝码的质量大于20.0g,故选D;
(4)①称量时先称空烧杯的质量再称烧杯和药品的质量,故错误;
②固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故正确;
③转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故错误;
④洗涤时要洗涤烧杯及玻璃棒2-3次,故错误;
⑤定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故正确;
⑥摇匀要在移液后摇匀一次,在定容后再摇匀一次,故错误;
故选:②⑤;
(5)若定容摇匀后有少量溶液外流,此时溶液的浓度已经均一而且确定,故对所配溶液的浓度无影响,故答案为:无影响.
根据提供的仪器可知,还需仪器有500ml容量瓶、胶头滴管,
故答案为:胶头滴管、500mL容量瓶;
(2)①量筒为量取仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④加水至刻度线的下方,操作正确,故④正确;
⑤定容时,眼睛应平视刻度线,故⑤错误;
⑥加盖摇匀,使溶液混合均匀,操作正确,故⑥正确;
故答案为:①③⑤;
(3)由于无450mL的容量瓶,故选用500mL的容量瓶,配制出500mL的1.0mol/L的溶液,500mL 1.0mol/L的氢氧化钠溶液中含有溶质的质量为:m=1.0mol/L×0.5L×40g/mol=20g,需要称量的氢氧化钠的质量为20.0g,而称量氢氧化钠固体时,要放到小烧杯里称量,故选用的砝码的质量大于20.0g,故选D;
(4)①称量时先称空烧杯的质量再称烧杯和药品的质量,故错误;
②固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故正确;
③转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故错误;
④洗涤时要洗涤烧杯及玻璃棒2-3次,故错误;
⑤定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故正确;
⑥摇匀要在移液后摇匀一次,在定容后再摇匀一次,故错误;
故选:②⑤;
(5)若定容摇匀后有少量溶液外流,此时溶液的浓度已经均一而且确定,故对所配溶液的浓度无影响,故答案为:无影响.
点评:本题考查了一定物质的量浓度的配制.要注意溶质的性质、同时要记住操作步骤,规范操作.

练习册系列答案
相关题目
下列说法正确的是( )
| A、H2SO4和H3PO4的摩尔质量相等 |
| B、在标准状况下18g水的体积约为22.4L |
| C、1molH2所占的体积约为22.4L |
| D、通常状况下,NA个 CO2分子占有的体积为22.4L |
A与B在容积为1L的密闭容器中发生反应:aA(s)+bB(g)?cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:下列说法正确的是( )
| n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
| 0.12 | 0.06 | 0.10 | t1 |
| 0.06 | 0.12 | 0.20 | t2 |
A、0~t1时间段内,平均反应速率v(B)=
| ||
B、若起始时n(D)=0,则t2时v(D)=
| ||
| C、升高温度,v(B)、vC)、v(D)均增大 | ||
| D、b:d=6:1 |
某溶液中仅含有Na+、H+、OH-、CH3COO-四种离子,下列说法不正确的是( )
| A、若溶液中部分粒子间满足:c(CH3COO-)=c(Na+) 则该溶液一定呈中性 |
| B、溶液中四种离子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、若溶液中粒子间满足:c(CH3COO-)>c( Na+)>c(H+)>c(OH-),则溶液中溶质一定是CH3COONa和CH3COOH |
某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:下列说法正确的是( )
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
| A、该溶液中可能含K+ |
| B、该溶液中肯定含有NO3?、SO42-、NH4+、CO32- |
| C、该溶液中一定不含NH4+ |
| D、该溶液中一定含K+,且c(K+)≥0.1mol/L |
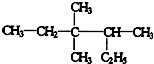
 ,
,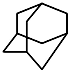 .的分子式为
.的分子式为