题目内容
有一包白色固体粉末,可能含有CuSO4、Ba(NO3)2、Na2SO4、K2CO3、KCl中的一种或几种,按以下步骤进行实验:
①将该固体粉末溶于足量水中得无色溶液和白色沉淀 ②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有 ;一定不含有 ;可能含有 (写化学式)
(2)生成白色沉淀的离子方程式为: 、
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是 .
①将该固体粉末溶于足量水中得无色溶液和白色沉淀 ②加入足量稀硝酸,沉淀部分溶解并有气体产生
根据以上实验现象推断:
(1)该白色粉末中一定含有
(2)生成白色沉淀的离子方程式为:
(3)沉淀加入稀硝酸反应的离子方程式为:
(4)要确定可能含有的物质,还需要进行的实验操作是
考点:几组未知物的检验
专题:
分析:①将此粉末溶于水,得到无色溶液和白色沉淀,则一定不含硫酸铜,含有Ba(NO3)2、Na2SO4或K2CO3中的至少一种;
②加入足量稀硝酸,沉淀部分溶解并有气体产生,则沉淀是碳酸钡和硫酸钡的混合物,同时含有硫酸钠、碳酸氢钠,据此回答.
②加入足量稀硝酸,沉淀部分溶解并有气体产生,则沉淀是碳酸钡和硫酸钡的混合物,同时含有硫酸钠、碳酸氢钠,据此回答.
解答:
解:①将此粉末溶于水,得到无色溶液和白色沉淀,则一定不含硫酸铜,含有Ba(NO3)2、Na2SO4或K2CO3中的至少一种;
②加入足量稀硝酸,沉淀部分溶解并有气体产生,则沉淀是碳酸钡和硫酸钡的混合物,同时含有硫酸钠、碳酸氢钠.
(1)据上述实验现象,判断此粉末中一定含有的物质是Ba(NO3)2、Na2SO4、K2CO3,一定没有的物质是CuSO4,可能含有KCl;
故答案为:Ba(NO3)2、Na2SO4、K2CO3;CuSO4;KCl;
(2)钡离子与硫酸根离子、碳酸根离子反应生成硫酸钡和碳酸钡沉淀,则生成白色沉淀的离子方程式为:Ba2++SO42-═BaSO4↓,Ba2++CO32-═BaCO3↓;
故答案为:Ba2++SO42-═BaSO4↓;Ba2++CO32-═BaCO3↓;
(3)沉淀是碳酸钡和硫酸钡的混合物,将足量稀硝酸加入白色沉淀中,沉淀碳酸钡溶解,并有气泡产生,即BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+=Ba2++H2O+CO2↑;
(4)要检验是否含有KCl,只需检验氯离子即可,则将①所得悬浊液过滤,在滤液中加入用稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明含有KCl,
故答案为:将①所得悬浊液过滤,在滤液中加入用稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明含有KCl.
②加入足量稀硝酸,沉淀部分溶解并有气体产生,则沉淀是碳酸钡和硫酸钡的混合物,同时含有硫酸钠、碳酸氢钠.
(1)据上述实验现象,判断此粉末中一定含有的物质是Ba(NO3)2、Na2SO4、K2CO3,一定没有的物质是CuSO4,可能含有KCl;
故答案为:Ba(NO3)2、Na2SO4、K2CO3;CuSO4;KCl;
(2)钡离子与硫酸根离子、碳酸根离子反应生成硫酸钡和碳酸钡沉淀,则生成白色沉淀的离子方程式为:Ba2++SO42-═BaSO4↓,Ba2++CO32-═BaCO3↓;
故答案为:Ba2++SO42-═BaSO4↓;Ba2++CO32-═BaCO3↓;
(3)沉淀是碳酸钡和硫酸钡的混合物,将足量稀硝酸加入白色沉淀中,沉淀碳酸钡溶解,并有气泡产生,即BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+=Ba2++H2O+CO2↑;
(4)要检验是否含有KCl,只需检验氯离子即可,则将①所得悬浊液过滤,在滤液中加入用稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明含有KCl,
故答案为:将①所得悬浊液过滤,在滤液中加入用稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明含有KCl.
点评:本题考查了物质的鉴别,考查学生物质的性质以及物质间的反应情况,注意平时知识的积累是解题的关键,题目难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
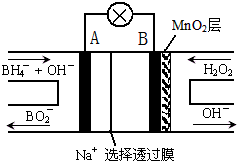

| A、电极B为正极 |
| B、放电过程中,Na+从正极区向负极区迁移 |
| C、电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA |
下列说法正确的是( )
| A、将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 |
| B、Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 |
| C、乙醇分子中含羟基,可与金属钠反应生成氢气 |
| D、MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂 |
X、Y、Z、M、W为五种短周期元素,其中X、Y、Z是原子序数依次增大的同周期元素,且它们的最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准情况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A、Y、Z、W能形成含有相同电子数的简单离子,且W形成的简单离子的半径最大 |
| B、XZ2、W2Z2均为直线形的共价化合物 |
| C、Z与M形成的3原子化合物比Y的M形成的4原子化合物稳定 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
25℃时,水的离子积为K,该温度下将a mol?L-1盐酸与b mol?L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是( )
A、混合液中:c(H+)≤
| ||
| B、混合液中:c(NH3H2O)+c(NH4+)=0.5a mol?L-1 | ||
| C、a=b | ||
| D、混合液中,c(H+)+c(NH4+)=c(OH-)+c(Cl-) |