题目内容
氢气是一种清洁、高效的新型能源.
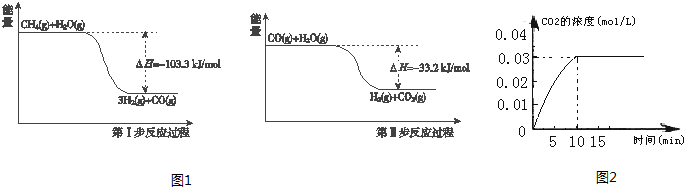
Ⅰ.用甲烷制取氢气的反应分为两步,其能量变化如图1所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
Ⅱ.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图2:
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为 ;
(3)下列改变中,能使平衡向正反应方向移动的是 .
A.升高温度
B.增大压强
C.增大H2O(g)的浓度
D.减少CO2(g)的浓度
(4)保持温度不变,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.4mol?L-1.通过计算,判断此时该反应进行的方向并说明理由:
.

Ⅰ.用甲烷制取氢气的反应分为两步,其能量变化如图1所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
Ⅱ.在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图2:
(2)在该温度下,从反应开始至达到平衡时,CO的平均反应速率为
(3)下列改变中,能使平衡向正反应方向移动的是
A.升高温度
B.增大压强
C.增大H2O(g)的浓度
D.减少CO2(g)的浓度
(4)保持温度不变,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的浓度为0.4mol?L-1.通过计算,判断此时该反应进行的方向并说明理由:
考点:热化学方程式,化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)根据盖斯定律来计算反应的焓变,根据热化学方程式的书写规律来书写热化学方程式;
(2)根据v=
计算二氧化碳的平均反应速率,再结合同一时间段内同一可逆反应中,各物质的反应速率之比等于其计量数之比计算一氧化碳的平均反应速率;
(3)根据温度、浓度、压强对化学平衡移动的影响来回答判断;
(4)计算该温度下反应的化学平衡常数,根据浓度商Qc与平衡常数K大小分析判断,Qc<Kc,平衡向正反应进行,Qc>Kc,平衡向逆反应进行,Qc═Kc,达平衡.
(2)根据v=
| △c |
| △t |
(3)根据温度、浓度、压强对化学平衡移动的影响来回答判断;
(4)计算该温度下反应的化学平衡常数,根据浓度商Qc与平衡常数K大小分析判断,Qc<Kc,平衡向正反应进行,Qc>Kc,平衡向逆反应进行,Qc═Kc,达平衡.
解答:
解:(1)根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3kJ?mol-1;根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ?mol-1;根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ?mol-1;
(2)根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ?mol-1;v(CO2)=
=
=0.003mol/(L.min),根据同一时间段内同一可逆反应中,各物质的反应速率之比等于其计量数之比计算一氧化碳的平均反应速率,所以v(CO)=v(CO2)=0.003mol/(L.min),
故答案为:0.003 mol?L-1?min-1;
(3)对于反应:CO(g)+H2O(g)?CO2(g)+H2(g)根据图示知道反应是放热的,
A.升高温度,平衡逆向移动,故A错误;
B.增大压强,平衡不会发生移动,故B错误;
C.增大H2O(g)的浓度,化学平衡正向移动,故C正确;
D.减少CO2(g)的浓度,化学平衡正向移动,故D正确;
故选CD;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.1 mol?L-1 0.1 mol?L-1 0 0
转化:0.03 mol?L-1 0.03 mol?L-1 0.03 mol?L-1 0.03 mol?L-1
平衡:0.07 mol?L-1 0.07 mol?L-1 0.03 mol?L-1 0.03 mol?L-1
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K═
=
,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1 mol?L-1 2 mol?L-1 0 0
转化:0.4 mol?L-1 0.4mol?L-1 0.4 mol?L-1 0.4 mol?L-1
平衡:0.6 mol?L-1 1.6 mol?L-1 0.4 mol?L-1 0.4 mol?L-1
浓度商Qc═
=
<Kc,平衡向正反应进行,v(正)>v(逆),
故答案为:正方向,Qc═
=
<Kc,所以该反应向正反应方向进行.
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ?mol-1;
(2)根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2kJ?mol-1;v(CO2)=
| △c |
| △t |
| 0.03mol/L |
| 10min |
故答案为:0.003 mol?L-1?min-1;
(3)对于反应:CO(g)+H2O(g)?CO2(g)+H2(g)根据图示知道反应是放热的,
A.升高温度,平衡逆向移动,故A错误;
B.增大压强,平衡不会发生移动,故B错误;
C.增大H2O(g)的浓度,化学平衡正向移动,故C正确;
D.减少CO2(g)的浓度,化学平衡正向移动,故D正确;
故选CD;
(4)CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.1 mol?L-1 0.1 mol?L-1 0 0
转化:0.03 mol?L-1 0.03 mol?L-1 0.03 mol?L-1 0.03 mol?L-1
平衡:0.07 mol?L-1 0.07 mol?L-1 0.03 mol?L-1 0.03 mol?L-1
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K═
| 0.03×0.03 |
| 0.07×0.07 |
| 9 |
| 49 |
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:1 mol?L-1 2 mol?L-1 0 0
转化:0.4 mol?L-1 0.4mol?L-1 0.4 mol?L-1 0.4 mol?L-1
平衡:0.6 mol?L-1 1.6 mol?L-1 0.4 mol?L-1 0.4 mol?L-1
浓度商Qc═
| 0.4×0.4 |
| 0.4×1.6 |
| 1 |
| 6 |
故答案为:正方向,Qc═
| 0.4×0.4 |
| 0.4×1.6 |
| 1 |
| 6 |
点评:本题考查反应速率的计算、化学平衡有关计算、化学平衡移动与影响因素等,注意平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.

练习册系列答案
相关题目
下列有关的命名正确的是( )
A、 2甲基3丁醇 |
B、 3乙基1丁烯 |
| C、(CH3CH2)2CHCH3 3甲基戊烷 |
D、 异戊烷 |

 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.