题目内容
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
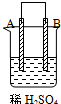 | 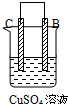 |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲、乙、丙为原电池装置,甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,乙中C的质量增加,说明C极上析出金属,为原电池正极,则B为负极,丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,原电池反应中负极较活泼,以此解答该题.
解答:
解:甲、乙、丙为原电池装置,甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,乙中C的质量增加,说明C极上析出金属,为原电池正极,则B为负极,丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,原电池反应中负极较活泼,则金属的活泼性顺序为D>A>B>C,
A.甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,故A错误;
B.乙中C的质量增加,说明C极上析出金属,为原电池正极,故B错误;
C.丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,故C错误;
D.由以上分析可知金属的活泼性顺序为D>A>B>C,故D正确.
故选D.
A.甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,故A错误;
B.乙中C的质量增加,说明C极上析出金属,为原电池正极,故B错误;
C.丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,故C错误;
D.由以上分析可知金属的活泼性顺序为D>A>B>C,故D正确.
故选D.
点评:本题考查了原电池原理,侧重于金属的活泼性的考查,注意根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
水溶液中能大量共存的一组离子是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Pb2+、NH4+、Cl-、SO42- |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、K+、Fe3+、CO32-、SO42- |
1999年,世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说,原子
X的中子数与电子数之差为( )
293 118 |
| A、0 | B、57 | C、118 | D、175 |
下列四项叙述中,错误的共有( )
①当增加反应物物质的量时,平衡一定向正反应方向移动
②当平衡向正反应方向移动时,反应物的转化率一定增大
③气体参加的反应达平衡时,若减小反应器容积,平衡不一定发生移动
④气体参加的反应达平衡时,向恒容反应器中充入某种气体,平衡一定不移动.
①当增加反应物物质的量时,平衡一定向正反应方向移动
②当平衡向正反应方向移动时,反应物的转化率一定增大
③气体参加的反应达平衡时,若减小反应器容积,平衡不一定发生移动
④气体参加的反应达平衡时,向恒容反应器中充入某种气体,平衡一定不移动.
| A、1项 | B、2项 | C、3项 | D、4项 |
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中分子数为0.5NA |
| C、7.8gNa2O2固体中阴、阳离子总数为0.3NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
下列有关C、N、S等非金属元素化合物的说法正确的是( )
| A、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| B、SO2具有漂白性可以是酸性高锰酸钾溶液褪色 |
| C、实验室可用NaOH溶液处理NO2和SO2废气 |
| D、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A、0.5mol雄黄(As4S4,结构如图)含有NA个S-S键  |
| B、1mol/L(NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个 |
| C、23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子 |
| D、将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒 |

