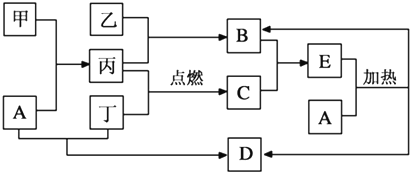
题目内容
下列有关C、N、S等非金属元素化合物的说法正确的是( )
| A、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| B、SO2具有漂白性可以是酸性高锰酸钾溶液褪色 |
| C、实验室可用NaOH溶液处理NO2和SO2废气 |
| D、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题,元素及其化合物
分析:A.碳酸氢钠温度下较强,受热后不分解;
B.二氧化硫被酸性高锰酸钾溶液氧化导致高锰酸钾溶液褪色,不是因为二氧化硫的漂白性;
C.二氧化氮、二氧化硫都能够与氢氧化钠溶液完全反应;
D.浓硫酸、浓硝酸能够与木炭反应,稀硫酸、稀硝酸不与木炭反应.
B.二氧化硫被酸性高锰酸钾溶液氧化导致高锰酸钾溶液褪色,不是因为二氧化硫的漂白性;
C.二氧化氮、二氧化硫都能够与氢氧化钠溶液完全反应;
D.浓硫酸、浓硝酸能够与木炭反应,稀硫酸、稀硝酸不与木炭反应.
解答:
解:A.NaHCO3、(NH4)2CO3加热会生成气体,而Na2CO3加热不产生气体,故A错误;
B.二氧化硫与酸性高锰酸钾溶液的反应为氧化还原反应,高锰酸钾溶液褪色不是二氧化硫的漂白性,二氧化硫表现了还原性,故B错误;
C.二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,二氧化氮和氢氧化钠发生氧化还原反应,生成硝酸钠、亚硝酸和钠水,反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,所以实验室可用NaOH溶液处理NO2和SO2废气,故C正确;
D.稀硝酸、稀硫酸不与木炭反应,故D错误;
故选C.
B.二氧化硫与酸性高锰酸钾溶液的反应为氧化还原反应,高锰酸钾溶液褪色不是二氧化硫的漂白性,二氧化硫表现了还原性,故B错误;
C.二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,二氧化氮和氢氧化钠发生氧化还原反应,生成硝酸钠、亚硝酸和钠水,反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,所以实验室可用NaOH溶液处理NO2和SO2废气,故C正确;
D.稀硝酸、稀硫酸不与木炭反应,故D错误;
故选C.
点评:本题考查了非金属元素化合物性质,题目难度中等,注意掌握常见元素单质及其化合物性质,明确二氧化硫漂白原理及浓硫酸、浓硝酸、稀硫酸、稀硝酸的化学性质区别.

练习册系列答案
相关题目
下列溶液一定呈中性的是( )
| A、c (H+)×c(OH-)=10-14的溶液 |
| B、n(H+)=n(OH-) 的溶液 |
| C、c (H+)=1.0×10-7 mol/L的溶液 |
| D、pH=3的酸与pH=11的碱等体积混合后的溶液 |
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
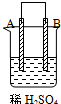 | 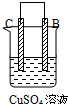 |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W |  |
| ① | CuO | Cu(OH)2 | CuSO4 | Cu | |
| ② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
下列物质长期露置在空气中不易变质的是( )
| A、漂白粉 | B、苯酚 |
| C、水玻璃 | D、碳酸钠粉末 |
 常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )
常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、K点所示溶液中c(A-)>c(M+) |
| C、N点水的电离程度小于K点水的电离程度 |
| D、K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol??L-1 |
下列有关实验操作不正确的是( )
| A、给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 |
| B、CCl4萃取碘水中碘的实验,分液时,水层应从分液漏斗下口放出,CCl4层从应上口倒出 |
| C、用容量瓶配制溶液,定容时加水超过了刻度线,必须进行重新配制 |
| D、测定溶液pH时,应用干燥洁净的玻璃棒蘸取溶液点在pH试纸上跟标准比色卡对照 |
下列生产工艺措施合理的是( )
| A、用SO2漂白银耳 |
| B、用硫酸清洗锅炉中的水垢 |
| C、高温下用镁还原SiO2制取粗硅 |
| D、用Na2S作沉淀剂,除去废水中Cu2+和Hg2+ |