题目内容
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中分子数为0.5NA |
| C、7.8gNa2O2固体中阴、阳离子总数为0.3NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.求出乙烯的物质的量,根据1mol乙烯中含4mol极性共价键来分析;
B.常温常压下,气体摩尔体积大于22.4L/mol,根据NO2气体中存在平衡:2NO2?N2O4,来分析分子数的变化;
C.1molNa2O2固体中含2molNa+和1molO22-;
D.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中胶粒的数目.
B.常温常压下,气体摩尔体积大于22.4L/mol,根据NO2气体中存在平衡:2NO2?N2O4,来分析分子数的变化;
C.1molNa2O2固体中含2molNa+和1molO22-;
D.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中胶粒的数目.
解答:
解:A.乙烯的物质的量n=
=
=0.5mol,而1mol乙烯中含4mol极性共价键,故0.5mol乙烯含2mol极性共价键,个数为2NA,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,故5.6LNO和5.6LO2的物质的量小于0.25mol,发生反应:2NO+O2=2NO2,氧气过量,而生成的NO2气体中存在平衡:2NO2?N2O4,故最后分子数小于0.5NA,故B错误;
C.Na2O2的物质的量n=
=
=0.1mol,而1molNa2O2固体中含2molNa+和1molO22-,故0.1molNa2O2固体中含0.2molNa+和0.1molO22-,故总数为0.3NA,故C正确;
D.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中含有的胶粒数目,故D错误;
故选C.
| V |
| Vm |
| 11.2 |
| 22.4 |
B.常温常压下,气体摩尔体积大于22.4L/mol,故5.6LNO和5.6LO2的物质的量小于0.25mol,发生反应:2NO+O2=2NO2,氧气过量,而生成的NO2气体中存在平衡:2NO2?N2O4,故最后分子数小于0.5NA,故B错误;
C.Na2O2的物质的量n=
| m |
| M |
| 7.8 |
| 78 |
D.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中含有的胶粒数目,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,难度中等.注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应中,属于氧化还原反应的是( )
①2Na2O2+4HCl═4NaCl+2H2O+O2↑
②2Na2O2+2H2O═4NaOH+O2↑
③Cl2+H2O═HCl+HClO
④Na2O+H2O═2NaOH.
①2Na2O2+4HCl═4NaCl+2H2O+O2↑
②2Na2O2+2H2O═4NaOH+O2↑
③Cl2+H2O═HCl+HClO
④Na2O+H2O═2NaOH.
| A、①②③ | B、①④ | C、②③ | D、全部 |
下列实验操作正确的是( )
| A、将氢氧化钠固体放在滤纸上称量 |
| B、用100 mL量筒量取8.5 mL蒸馏水 |
| C、制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D、配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
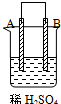 | 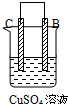 |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,下列说法正确的是( )
| A、一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢 | ||
| B、若甲醇的生成速率等于一氧化碳的消耗速率,则该反应达到平衡状态 | ||
C、升高温度,重新达到平衡时,
| ||
| D、使用催化剂,反应的平衡常数增大 |
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W |  |
| ① | CuO | Cu(OH)2 | CuSO4 | Cu | |
| ② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
下列物质长期露置在空气中不易变质的是( )
| A、漂白粉 | B、苯酚 |
| C、水玻璃 | D、碳酸钠粉末 |
 常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )
常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、K点所示溶液中c(A-)>c(M+) |
| C、N点水的电离程度小于K点水的电离程度 |
| D、K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol??L-1 |
下列说法错误的是;( )
| A、过量铁与浓硫酸加热反应可以得到氢气 |
| B、硅酸盐NaAlSiO4?nH2O可改写成氧化物形式为:Na2O?Al2O3?2SiO2?2nH2O |
| C、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| D、Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属A1、Cu、Fe都大 |