题目内容
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A、0.5mol雄黄(As4S4,结构如图)含有NA个S-S键  |
| B、1mol/L(NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个 |
| C、23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子 |
| D、将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据雄黄的结构可知,黑球为As,白球为S,雄黄中不存在S-S键;
B.缺少硫酸铵溶液的体积,无法判断磷酸根离子、铵根离子的数目;
C.钠为1价金属,23g钠的物质的量为1mol,1mol钠完全反应失去1mol电子;
D.氢氧化铁胶粒为氢氧化铁的聚集体.
B.缺少硫酸铵溶液的体积,无法判断磷酸根离子、铵根离子的数目;
C.钠为1价金属,23g钠的物质的量为1mol,1mol钠完全反应失去1mol电子;
D.氢氧化铁胶粒为氢氧化铁的聚集体.
解答:
解:A.S原子最外层6个电子,能够形成2个共价键,As最外层5电子,能够形成3个共价键,所以该结构简式中,黑球为As原子,白球为S原子,该结构简式中不存在S-S键,故A错误;
B.没有告诉1mol/L的硫酸铵溶液的体积,无法计算溶液中溶质硫酸铵的物质的量,故B错误;
C.23g钠的物质的量为1mol,1mol钠完全反应,无论生成氧化钠还是过氧化钠,转移电子都是1mol,故C正确;
D.由于氢氧化铁胶粒为氢氧化铁的聚集体,无法计算获得的氢氧化铁胶粒的数目,故D错误;
故选C.
B.没有告诉1mol/L的硫酸铵溶液的体积,无法计算溶液中溶质硫酸铵的物质的量,故B错误;
C.23g钠的物质的量为1mol,1mol钠完全反应,无论生成氧化钠还是过氧化钠,转移电子都是1mol,故C正确;
D.由于氢氧化铁胶粒为氢氧化铁的聚集体,无法计算获得的氢氧化铁胶粒的数目,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项A为难点和易错点,注意合理分析雄黄的结构.

练习册系列答案
相关题目
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
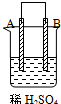 | 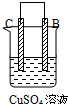 |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
 常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )
常温下,向l00mL 0.01mol?L-1HA溶液中逐滴加入0.02mol??L-1MOH溶液,如图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、K点所示溶液中c(A-)>c(M+) |
| C、N点水的电离程度小于K点水的电离程度 |
| D、K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol??L-1 |
下列有关实验操作不正确的是( )
| A、给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 |
| B、CCl4萃取碘水中碘的实验,分液时,水层应从分液漏斗下口放出,CCl4层从应上口倒出 |
| C、用容量瓶配制溶液,定容时加水超过了刻度线,必须进行重新配制 |
| D、测定溶液pH时,应用干燥洁净的玻璃棒蘸取溶液点在pH试纸上跟标准比色卡对照 |
若NA为阿伏伽德罗常数的值,下列说法不正确的是( )
| A、1molCl2与足量的铁反应,转移电子数为3NA |
| B、常温常压下,1mol氦气含有的原子数为NA |
| C、标准状况下,2.24L丁烷分子所含的C-H 键数为NA |
| D、1molNa2O2所含的阴离子数目为NA |
下列说法错误的是;( )
| A、过量铁与浓硫酸加热反应可以得到氢气 |
| B、硅酸盐NaAlSiO4?nH2O可改写成氧化物形式为:Na2O?Al2O3?2SiO2?2nH2O |
| C、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| D、Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属A1、Cu、Fe都大 |
下列生产工艺措施合理的是( )
| A、用SO2漂白银耳 |
| B、用硫酸清洗锅炉中的水垢 |
| C、高温下用镁还原SiO2制取粗硅 |
| D、用Na2S作沉淀剂,除去废水中Cu2+和Hg2+ |
下列装置图正确的是( )
A、 容量瓶定容 |
B、 海水蒸馏原理 |
C、 验证乙炔的性质 |
D、 验证牺牲阳极的阴极保护法 |