题目内容
8.下列液体温度均处在25℃,有关叙述正确的是( )| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
分析 A.常温下pH小于7,溶液呈酸性,可能为酸或强酸强碱盐,也可能为酸式盐;
B.根据溶液的pH=-lgc(H+)进行计算;
C.稀释后溶液中氢氧根离子浓度为0.1mol/L,溶液的pH=13;
D.碱溶液稀释后不可能变为酸溶液.
解答 解:A.某物质的溶液pH<7,该溶液呈酸性,可能为酸式盐,如硫酸氢钠、亚硫酸氢钠溶液,不一定是酸或强酸弱碱盐,故A错误;
B.pH=4.5的番茄汁中c(H+)=10-4.5mol/L,pH=6.5的牛奶中c(H+)=10-6.5mol/L,前者溶液中氢离子浓度为后者100倍,故B正确;
C.1 L 0.1 mol•L-1的Ba(OH)2溶液中氢氧根离子浓度为0.2mol/L,将该溶液稀释为2 L时氢氧根离子浓度为0.1mol/L,稀释后溶液的pH=13,故C错误;
D.pH=8的NaOH溶液稀释100倍后,溶液中企业广告离子浓度只能无限接近10-7mol/L,溶液的pH不可能小于7,故D错误;
故选B.
点评 本题考查溶液pH的计算,题目难度中等,明确盐的水解原理为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.在1.01×105Pa、150℃时,将3LC2H4、1LC2H2、1LC2H6与20LO2混合并点燃,完全反应后,恢复至原来状态,气体的体积是( )
| A. | 10L | B. | 15L | C. | 25L | D. | 30L |
16.下列实验现象正确的是( )
| A. | 将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成 | |
| B. | 将足量的SO2气体通入Ba(OH)2溶液中有白色沉淀生成 | |
| C. | 将SO2气体通入BaCl2溶液中有白色沉淀生成 | |
| D. | 将Na2SO3与BaCl2溶液混合后生成白色沉淀,加稀硝酸沉淀全部溶解 |
3.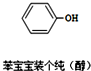 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )
 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )| A. | 碳原子采用sp3杂化 | |
| B. | 氧原子采用sp2杂化 | |
| C. | 该有机物属于醇类 | |
| D. | 该分子中的13个原子有可能处于同一平面上 |
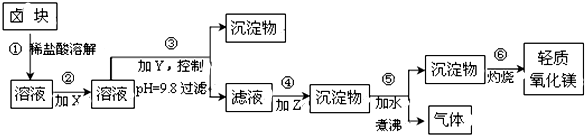
13.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁.
查阅资料得下表相关数据:
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

查阅资料得下表相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
20.下列叙述正确的是( )
| A. | 离子化合物中只存在离子键 | |
| B. | 任何物质中都存在化学键 | |
| C. | 金属氧化物一定是碱性氧化物,非金属氧化物可能不是酸性氧化物 | |
| D. | 仅由非金属元素组成的化合物中可能含离子键,但仅由两个非金属原子构成的微粒不含离子键 |
17.下列氢化物中稳定性最强的是( )
| A. | H2O | B. | NH3 | C. | H2S | D. | HF |
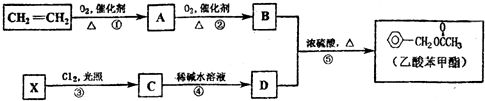
 ,④的反应类型是取代反应.
,④的反应类型是取代反应.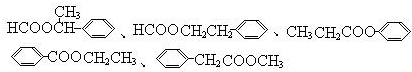 任意一种.
任意一种. .
.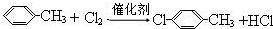 .
.